①化合物“HQ”(C6H6O2)可用作显影剂,“HQ”可以与三氯化铁溶液发生显色反应。“HQ”还能发生的反应是 (选填序号)。
①与金属钠反应 ②水解反应 ③加聚反应 ④与溴水反应 ⑤与碳酸钠反应
②已知,1,3—丁二烯的一类二烯烃能发生与具有双键的化合物进行1,4—加成反应生成环状化合物,这类反应称为双烯合成,例如: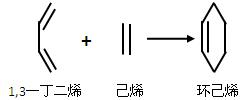
在下列横线上写出适当的反应物或生成物的键线式,完成下列反应: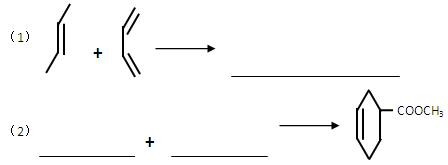
①化合物“HQ”(C6H6O2)可用作显影剂,“HQ”可以与三氯化铁溶液发生显色反应。“HQ”还能发生的反应是 (选填序号)。
①与金属钠反应 ②水解反应 ③加聚反应 ④与溴水反应 ⑤与碳酸钠反应
②已知,1,3—丁二烯的一类二烯烃能发生与具有双键的化合物进行1,4—加成反应生成环状化合物,这类反应称为双烯合成,例如: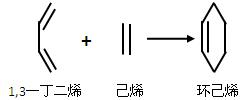
在下列横线上写出适当的反应物或生成物的键线式,完成下列反应: