下图中A—H为中学化学常用仪器,请根据要求回答: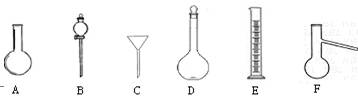
(1)上述仪器中,D的瓶体上标有(图中未画出)刻度线、温度、 ▲ 。
(2)分离乙醇和水的混合物,需用到上述仪器中的 ▲ (填仪器的编号字母)。
(3)下列关于仪器B的使用方法中,正确的是 ▲ 。
A.使用前应先检查是否漏液
B.可用于分离乙醇和水的混合物
C.用于分液时应先打开分液漏斗上面的塞子
下图中A—H为中学化学常用仪器,请根据要求回答:
(1)上述仪器中,D的瓶体上标有(图中未画出)刻度线、温度、 ▲ 。
(2)分离乙醇和水的混合物,需用到上述仪器中的 ▲ (填仪器的编号字母)。
(3)下列关于仪器B的使用方法中,正确的是 ▲ 。
A.使用前应先检查是否漏液
B.可用于分离乙醇和水的混合物
C.用于分液时应先打开分液漏斗上面的塞子