将煤焦油中的苯、甲苯和苯酚进行分离,可采用如下图所示方法和操作: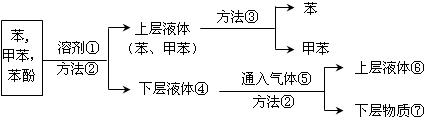
(1)写出物质①和⑤的分子式: ① ⑤ 。
(2)写出分离方法②和③的名称:② ③ 。
(3)下层液体④通入气体⑤反应的化学方程式。 。
(4)分离出的苯酚含在 中(填编号)。
将煤焦油中的苯、甲苯和苯酚进行分离,可采用如下图所示方法和操作:
(1)写出物质①和⑤的分子式: ① ⑤ 。
(2)写出分离方法②和③的名称:② ③ 。
(3)下层液体④通入气体⑤反应的化学方程式。 。
(4)分离出的苯酚含在 中(填编号)。