制备氮化镁的装置示意图如下:
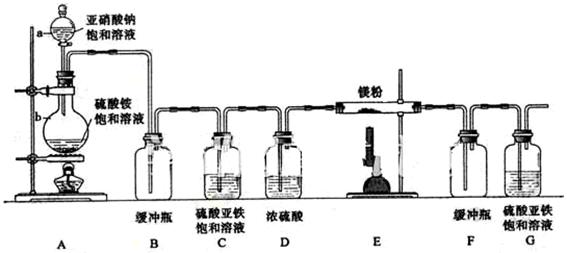
回答下列问题:
(1)检查装置气密性的方法是,
的名称是,的名称是;
(2)写出和反应制备氮气的化学方程式;
(3)的作用是,的作用是,是否可以把和的位置对调并说明理由;
(4)写出中发生反应的化学方程式 ;
(5)请用化学方法确定是否有氮化镁生成,并检验是否含有未反应的镁,写出实验操作及现象。
制备氮化镁的装置示意图如下:

回答下列问题:
(1)检查装置气密性的方法是,
的名称是,的名称是;
(2)写出和反应制备氮气的化学方程式;
(3)的作用是,的作用是,是否可以把和的位置对调并说明理由;
(4)写出中发生反应的化学方程式 ;
(5)请用化学方法确定是否有氮化镁生成,并检验是否含有未反应的镁,写出实验操作及现象。