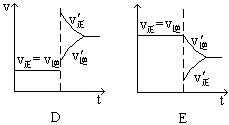
下图表示的是N2 + 3H2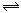 2NH3;△H<0达到平衡后,改变条件建立的新平衡(图中横坐标表示反应时间, 纵坐标表示反应速率)
2NH3;△H<0达到平衡后,改变条件建立的新平衡(图中横坐标表示反应时间, 纵坐标表示反应速率) 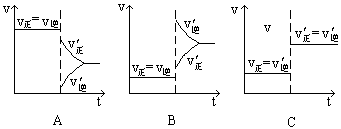
(1)表示减少H2的量而建立新平衡的是 。
(2)表示压缩气体, 体积减小而建立新平衡的是 。
(3)表示降低温度而建立新平衡的是 。
(4)表示升高温度而建立新平衡的是 。
(5)表示加入催化剂后而建立新平衡的是 。
下图表示的是N2 + 3H2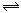 2NH3;△H<0达到平衡后,改变条件建立的新平衡(图中横坐标表示反应时间, 纵坐标表示反应速率)
2NH3;△H<0达到平衡后,改变条件建立的新平衡(图中横坐标表示反应时间, 纵坐标表示反应速率) 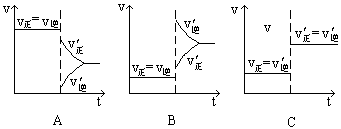

(1)表示减少H2的量而建立新平衡的是 。
(2)表示压缩气体, 体积减小而建立新平衡的是 。
(3)表示降低温度而建立新平衡的是 。
(4)表示升高温度而建立新平衡的是 。
(5)表示加入催化剂后而建立新平衡的是 。