某合金中铜和铁的物质的量均为0.3mol,将其全部投入b 4
4  的硝酸溶液中,使其充分反应(假设NO是唯一的还原产物)。
的硝酸溶液中,使其充分反应(假设NO是唯一的还原产物)。
(1)若金属有剩余,其质量为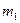 g,在溶液中再滴人稀硫酸后,剩余金属为
g,在溶液中再滴人稀硫酸后,剩余金属为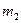 g,则
g,则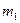 与
与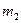 的关系为:
的关系为: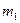
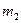 (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。
(2)若b=450 ,则溶液中的金属阳离子为 。
,则溶液中的金属阳离子为 。
(3)若合金与硝酸溶液恰好反应完全,求b的取值范围(要有计算过程)
某合金中铜和铁的物质的量均为0.3mol,将其全部投入b 4
4  的硝酸溶液中,使其充分反应(假设NO是唯一的还原产物)。
的硝酸溶液中,使其充分反应(假设NO是唯一的还原产物)。
(1)若金属有剩余,其质量为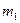 g,在溶液中再滴人稀硫酸后,剩余金属为
g,在溶液中再滴人稀硫酸后,剩余金属为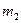 g,则
g,则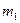 与
与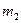 的关系为:
的关系为: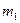
 (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。
(2)若b=450 ,则溶液中的金属阳离子为 。
,则溶液中的金属阳离子为 。
(3)若合金与硝酸溶液恰好反应完全,求b的取值范围(要有计算过程)