火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态双氧水。当把0.4mol液态肼和0.8mol H2O2混合反应,生成氮气和水蒸气,放出256.7kJ的热量(相当于25℃、101 kPa下测得的热量)。
(1)反应的热化学方程式为 。
(2)又已知H2O(l)=H2O(g) ΔH=+44kJ/mol。则16g液态肼与液态双氧水反应生成液态水时放出的热量是 kJ。
(3)此反应用于火箭推进,除释放大量热和快速产生大量气体外,还有一个很大的优点是 。
(4)盖斯定律在生产和科学研究中有很重要的意义。已知把煤作为燃料可通过下列两种途径:
途径I:C(s) +O2 (g) == CO2(g) △H1<0 ①
途径II:先制成水煤气:C(s) +H2O(g) == CO(g)+H2(g) △H2>0 ②
再燃烧水煤气:2CO(g)+O2 (g) == 2CO2(g) △H3<0 ③
2H2(g)+O2 (g) == 2H2O(g) △H4<0 ④
则△H1、△H2、△H3、△H4的数学关系式是 。
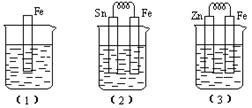
 6NH4Cl+ N2 ,回答下列问题:
6NH4Cl+ N2 ,回答下列问题: _____,B1__________,B2__________;
_____,B1__________,B2__________; 的
的 溶液中离子浓度大小排序 ________________;
溶液中离子浓度大小排序 ________________; ,
,

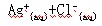
 mol / L MgCl2溶液中,搅拌后,在相同温度下Ag+浓度由大到小的顺序(用序号回答)是 ______ > ______ > ______ > ______。
mol / L MgCl2溶液中,搅拌后,在相同温度下Ag+浓度由大到小的顺序(用序号回答)是 ______ > ______ > ______ > ______。 粤公网安备 44130202000953号
粤公网安备 44130202000953号