(1)右图是我校化学实验室从化学试剂商店买回的硫酸试剂标签上的部分内容。计算:(要求写出简要计算过程)用该浓硫酸配制200mL1mol/L的稀硫酸,用量筒所需量取该浓硫酸的体积是多少mL?
(2)在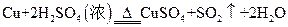 反应中,
反应中,
若有3.2 g的Cu参与反应,则被还原的H2SO4的物质的量是多少?
(1)右图是我校化学实验室从化学试剂商店买回的硫酸试剂标签上的部分内容。计算:(要求写出简要计算过程)用该浓硫酸配制200mL1mol/L的稀硫酸,用量筒所需量取该浓硫酸的体积是多少mL?
(2)在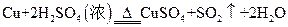 反应中,
反应中,
若有3.2 g的Cu参与反应,则被还原的H2SO4的物质的量是多少?