在100mL NaOH溶液中加入NH4NO3和(NH4)2SO4的固体混合物,加热充分反应。下图表示加入的混合物的质量与产生的气体体积(标准状况)的关系。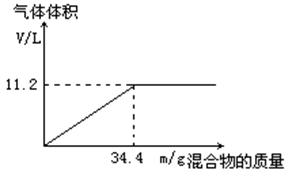
(1) NaOH溶液的物质的量浓度为 。
(2)当NaOH溶液的体积为80mL,固体混合物的质量为34.4g,充分反应后,生成气体的体积在标准状况下为 升。
(3)当NaOH溶液的体积为120mL,固体混合物的质量仍为34.4g,充分反应后,生成气体的体积在标准状况下为 升。
在100mL NaOH溶液中加入NH4NO3和(NH4)2SO4的固体混合物,加热充分反应。下图表示加入的混合物的质量与产生的气体体积(标准状况)的关系。
(1) NaOH溶液的物质的量浓度为 。
(2)当NaOH溶液的体积为80mL,固体混合物的质量为34.4g,充分反应后,生成气体的体积在标准状况下为 升。
(3)当NaOH溶液的体积为120mL,固体混合物的质量仍为34.4g,充分反应后,生成气体的体积在标准状况下为 升。