(每空2分)下列各组微粒或物质中:
| A.O2和O3 | B.12 6C和13 6C |
C.CH3CH2CH2CH3和CH3CH2CH( CH3)2 CH3)2 |
|
D.CH3CH2CH2CH3和CH3CH(CH3)2 E.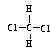 和 和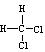 |
其中, 组互为 同位素; 组互为同素异形体; 组属于同系物;
同位素; 组互为同素异形体; 组属于同系物;
组互为同分异构体; 组互为同一物质。
(每空2分)下列各组微粒或物质中:
| A.O2和O3 | B.12 6C和13 6C |
C.CH3CH2CH2CH3和CH3CH2CH( CH3)2 CH3)2 |
|
D.CH3CH2CH2CH3和CH3CH(CH3)2 E.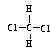 和 和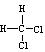 |
其中, 组互为 同位素; 组互为同素异形体; 组属于同系物;
同位素; 组互为同素异形体; 组属于同系物;
组互为同分异构体; 组互为同一物质。