已知F为高分子化合物: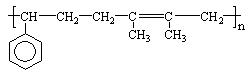
C分子结构中只含有一种氢。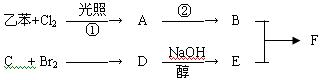
(1)写出下列物质结构简式
A: C: E:
(2)判断①反应类型:
(3)写出②反应进行所需条件:
(4)写出C7H80所有含苯环结构的同分异构体:(提示:5种同分异构体)
已知F为高分子化合物:
C分子结构中只含有一种氢。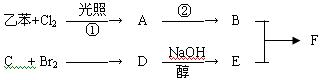
(1)写出下列物质结构简式
A: C: E:
(2)判断①反应类型:
(3)写出②反应进行所需条件:
(4)写出C7H80所有含苯环结构的同分异构体:(提示:5种同分异构体)