在试管A中加入3mL乙醇,然后边振荡试管边慢慢加入2mL乙醇,按右图所示连接好装置进行实验,以制取乙酸乙酯。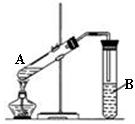
(1)试管B中盛放的试剂是 ;反应中浓硫酸的作用是 。
(2)乙醇与乙酸反应的化学方程式是 。
(3)B中的导管不能插入液面以下的原因是 。
(4)儿童30g乙酸与46g乙醇反应,如果实际产率是理论产率的60%,则可得到的乙酸乙酯的质量是 g。
在试管A中加入3mL乙醇,然后边振荡试管边慢慢加入2mL乙醇,按右图所示连接好装置进行实验,以制取乙酸乙酯。
(1)试管B中盛放的试剂是 ;反应中浓硫酸的作用是 。
(2)乙醇与乙酸反应的化学方程式是 。
(3)B中的导管不能插入液面以下的原因是 。
(4)儿童30g乙酸与46g乙醇反应,如果实际产率是理论产率的60%,则可得到的乙酸乙酯的质量是 g。