某元素同位素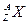 ,其氯化物XCl2 1.11g溶于水制成溶液后,加入1mol/L的AgNO3溶液20mL恰好完全反应。若这种同位素原子核内有20个中子,则:
,其氯化物XCl2 1.11g溶于水制成溶液后,加入1mol/L的AgNO3溶液20mL恰好完全反应。若这种同位素原子核内有20个中子,则:
(1)Z值和A值;Z= ;A= ;
(2)X元素在周期表中的位置 ;
(3)根据已学知识推测,把X的单质放入水中反应的化学方程式为. 。
某元素同位素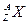 ,其氯化物XCl2 1.11g溶于水制成溶液后,加入1mol/L的AgNO3溶液20mL恰好完全反应。若这种同位素原子核内有20个中子,则:
,其氯化物XCl2 1.11g溶于水制成溶液后,加入1mol/L的AgNO3溶液20mL恰好完全反应。若这种同位素原子核内有20个中子,则:
(1)Z值和A值;Z= ;A= ;
(2)X元素在周期表中的位置 ;
(3)根据已学知识推测,把X的单质放入水中反应的化学方程式为. 。