(6分)
一定温度下,测得某纯水的pH为6.5。试计算:
(1)此时水的离子积常数Kw为多少?
(2)若在此纯水中加一定量Ba(OH)2固体,配制成0.005mol·L-1。的Ba(OH)2溶液,保持原温度,其溶液的pH为多少?
(3)取上述Ba(OH)2溶液200mL,加入含0.01mol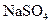 的浓溶液,待反应完全后,上层清液中Ba2+浓度变为多少?[体积变化忽略不计,Ksp(BaSO4)=1.08×10-10]
的浓溶液,待反应完全后,上层清液中Ba2+浓度变为多少?[体积变化忽略不计,Ksp(BaSO4)=1.08×10-10]
(6分)
一定温度下,测得某纯水的pH为6.5。试计算:
(1)此时水的离子积常数Kw为多少?
(2)若在此纯水中加一定量Ba(OH)2固体,配制成0.005mol·L-1。的Ba(OH)2溶液,保持原温度,其溶液的pH为多少?
(3)取上述Ba(OH)2溶液200mL,加入含0.01mol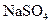 的浓溶液,待反应完全后,上层清液中Ba2+浓度变为多少?[体积变化忽略不计,Ksp(BaSO4)=1.08×10-10]
的浓溶液,待反应完全后,上层清液中Ba2+浓度变为多少?[体积变化忽略不计,Ksp(BaSO4)=1.08×10-10]