茉莉花是 一首脍炙人口的民歌。茉莉花香气的成份有多种,乙酸苯甲酯
一首脍炙人口的民歌。茉莉花香气的成份有多种,乙酸苯甲酯
( ),是其中的一种,它可以从茉莉花中提取,也可以用甲苯和乙醇
|
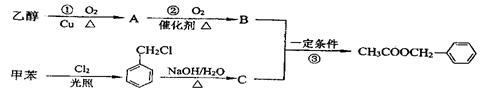
为原料进行人工合成。一种合成路线如下:
(1)C的结构简式为 。
(2)写出反应①的化学方程式: 。
(3)反应③的化学方程式: 。其反应类型为 。
(4)反应 (填序号)原子的理论利用率为100%,符合绿色化学的要求。
(5)写出符
 合下列条件的乙酸苯甲酯一种同分异构体:①含苯环结构 ②具有酯的结构:
合下列条件的乙酸苯甲酯一种同分异构体:①含苯环结构 ②具有酯的结构:  。
。(6)指出乙醇的两个重要用途 、 。

 粤公网安备 44130202000953号
粤公网安备 44130202000953号