某可逆反应从0—2分钟进行过程中, 在不同反应时 间各物质的量的变化情况如下图所示。则该反应的的反应物是 ,生成物是 ,化学方程式为 ;反应开始至2分钟时,能否用C表示反应速率?若能,其反应速率为 _____ ,若不能,则其原因为 _ ;2分钟后A、B、C各物质的量不再随时间的变化而变化,说明在这个条件下,反应已达到了____ 状态。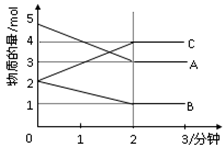
某可逆反应从0—2分钟进行过程中, 在不同反应时 间各物质的量的变化情况如下图所示。则该反应的的反应物是 ,生成物是 ,化学方程式为 ;反应开始至2分钟时,能否用C表示反应速率?若能,其反应速率为 _____ ,若不能,则其原因为 _ ;2分钟后A、B、C各物质的量不再随时间的变化而变化,说明在这个条件下,反应已达到了____ 状态。