合成氨工业的部分工艺流程如下图所示: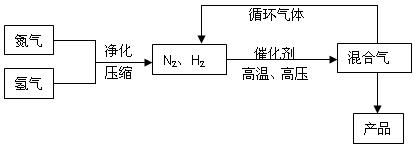
请你回答下列问题:
(1)已知:N2(g)+O2(g) =2NO(g);△H=180.5kJ·mol-1
4NH3(g)+5O2(g)=4NO(g)+6H2O(g) ;△H=–905kJ·mol-1
2H2(g)+O2(g)=2H2O(g) ;△H=–483.6kJ·mol-1
则N2(g)+3H2(g)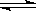 2NH3(g)的△H=_________________。
2NH3(g)的△H=_________________。
(2)改变下列条件,能使平衡向正反应方向进行且平衡常数不变的是_________。
| A.增大压强 | B.降低温度 | C.使用催化剂 | D.增大反应物的浓度 |
(3)在一定条件下,将2molN2与5molH2混合于一个10L的密闭容器中,反应情况如右图所示:
①求5min内的平均反应速率v(NH3)=_______________
②达到平衡时NH3的体积分数为___________%
(4)近年来科学家提出了电解合成氨的方法:采用高质子导电性的SCY陶瓷(能传递H+)为介质,用吸附在它内外表面上的金属钯多晶薄膜做电极,实现了高转化率的电解法合成氨(装置如图)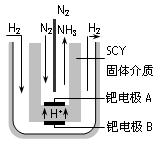
请回答:钯电极A是电解池的_______极(填“阳”或“阴”),该极上的电极反应式是_________________________
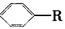 可以被KMnO4酸性溶液氧化生成
可以被KMnO4酸性溶液氧化生成 ,但若烷基R中直接与苯环连接的碳原子上没有C—H键,则不容易被
,但若烷基R中直接与苯环连接的碳原子上没有C—H键,则不容易被 氧化得到
氧化得到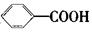 。现有分子式是C11H16的一烷基取代苯,已知它可以被氧化成为
。现有分子式是C11H16的一烷基取代苯,已知它可以被氧化成为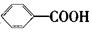 的同分异构体共有7种,其中的3种是:
的同分异构体共有7种,其中的3种是:
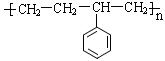 _________________________
_________________________ ________________________
________________________
 粤公网安备 44130202000953号
粤公网安备 44130202000953号