某研究小组在查阅资料中发现,常温下氯气可以氧化氨气获得氮气。该小组由此设计出制取氮气的思路,设计装置图如下。其中A、F分别为氨气和氯气的发生装置,C为纯净干燥的氯气与氨气反应的装置。
请回答下列问题:
(1)装置A中的烧瓶内固体不可以选用_________(填序号)。
A.生石灰 B.碱石灰 C.五氧化二磷 D.烧碱
(2)装置F发生反应的离子方程式是___________________________。
(3)B装置的作用_________;E装置的作用__________________。
(4)写出制取 的化学方程式__________________;反应生成
的化学方程式__________________;反应生成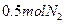 ,转移的电子数是_________
,转移的电子数是_________ 。
。
(5)当反应装置里的氨气和氯气的物质的量之比大于_________时,尾气里一定含有氨气;当反应装置里的氯气和氨气的物质的量之比大于_________时,尾气里一定含有氯气。


 粤公网安备 44130202000953号
粤公网安备 44130202000953号