三草酸合铁(Ⅲ)酸钾(K3[Fe(C2O4)3]·xH2O)是制备负载型活性铁催化剂的主要原料,也是一些有机反应的良好催化剂,在工业上具有一定的应用价值。常用三氯化铁与草酸钾直接合成三草酸合铁(Ⅲ)酸钾。
为测定该晶体中铁的含量和草酸根的含量,某实验小组做了如下实验:
Ⅰ 草酸根含量的测定
步骤一:称量10.00g三草酸合铁(Ⅲ)酸钾晶体,配制成500ml溶液。
步骤二:取所配溶液25.00ml于锥形瓶中,加稀H2SO4酸化,用0.060 mol•L-1 KMnO4标准溶液滴定至终点(保留溶液待下一步分析使用),消耗KMnO4溶液20.02ml。
重复步骤二操作,滴定消耗0.060mol/L KMnO4溶液19.98ml。
Ⅱ 铁含量的测定
步骤三:向步骤二所得溶液中加入一小匙锌粉,加热至黄色刚好消失,过滤,洗涤,将过滤及洗涤所得溶液收集到锥形瓶中,此时,溶液仍呈酸性。
步骤四:用0.010mol/L KMnO4溶液滴定步骤三所得溶液至终点,消耗KMnO4溶液20.01ml。
重复步骤二至四操作,滴定消耗0.010mol/L KMnO4溶液19.99ml。
请回答下列问题:
(1)配制三草酸合铁酸钾溶液的操作步骤依次是:称量、_____、转移、洗涤并转移、_____、摇匀;
(2)滴定时,下列滴定方式中,最合理的是 (夹持部分略去)(填字母序号)。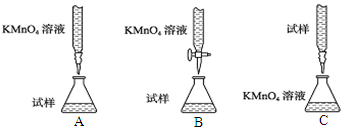
理由为_______________;滴定终点现象为:_____________;若在接近滴定终点时,用少量蒸馏水将锥形瓶内壁冲洗一下,再继续滴定至终点,对实验结果会_____________(偏大、偏小、无影响);
(3)加入锌粉的目的是________________________________________;
(4)滴定中MnO4-被还原成Mn2+ ,试写出步骤二和三中发生反应的离子方程式:
_________________,__________________。
(5)实验测得该晶体中铁的质量分数为__________。在步骤二中,若加入的KMnO4溶液量不够,则测得的铁含量__________。(选填“偏低”、“偏高”或“不变”)
 _________
_________
 CuSO4。②由Cu
CuSO4。②由Cu CuSO4,试回答:
CuSO4,试回答: 、SO
、SO 四种离子中的一种或几种。取少量这种溶液分别盛于三支试管中,进行如下实验:
四种离子中的一种或几种。取少量这种溶液分别盛于三支试管中,进行如下实验: 粤公网安备 44130202000953号
粤公网安备 44130202000953号