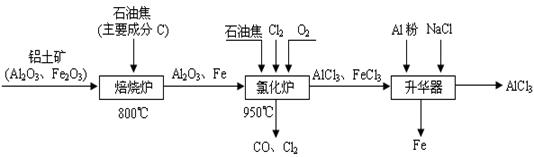
(本题16分)工业上利用CO2和H2在一定条件下反应合成甲醇。
(1)已知在常温常压下:
① 2CH3OH(l) + 3O2(g) = 2CO2(g) + 4H2O(g) ΔH=-1275.6 kJ/mol
②2CO (g)+ O2(g) = 2CO2(g) ΔH=-566.0 kJ/mol
③H2O(g) = H2O(l) ΔH=-44.0 kJ/mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:____________ ________
(2)甲醇脱氢可制取甲醛CH3OH(g) HCHO(g)+H2(g),甲醇的平衡转化率随温度变化曲线如下图所示。回答下列问题:
HCHO(g)+H2(g),甲醇的平衡转化率随温度变化曲线如下图所示。回答下列问题:

①脱氢反应的△H_____0,600K时,Y点甲醇的υ(正) _____υ(逆)(填“>”或“<”)
②从Y点到X点可采取的措施是_______________________________________________。
③有同学计算得到在t1K时,该反应的平衡常数为8.1mol·L-1。你认为正确吗?请说明理由__________________________________________________________________________。
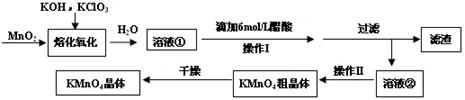
(3)纳米级Cu2O由于具有优良的催化性能而受到关注。在相同的密闭容器中,使用不同方法制得的Cu2O(Ⅰ)和(Ⅱ)分别进行催化CH3-OH的脱氢实验:
CH3OH(g) HCHO(g)+H2(g)
HCHO(g)+H2(g)
CH3OH的浓度(mol·L-1)随时间t (min)变化如下表:
序号
|
温度
|
0
|
10
|
20
|
30
|
40
|
50
|
①
|
T1
|
0.050
|
0.0492
|
0.0486
|
0.0482
|
0.0480
|
0.0480
|
②
|
T1
|
0.050
|
0.0488
|
0.0484
|
0.0480
|
0.0480
|
0.0480
|
③
|
T2
|
0.10
|
0.094
|
0.090
|
0.090
|
0.090
|
0.090
|
可以判断:实验①的前20 min的平均反应速率 ν(H2)= ;实验温度T1 T2(填“>”、“<”);催化剂的催化效率:实验① 实验②(填“>”、“<”)。
(4)用CH3-OH、空气、KOH溶液和石墨电极可构成燃料电池。则该电池的负极反应式为:
___________________________________________。

 HCHO(g)+H2(g),甲醇的平衡转化率随温度变化曲线如下图所示。回答下列问题:
HCHO(g)+H2(g),甲醇的平衡转化率随温度变化曲线如下图所示。回答下列问题:

 HCOOH(l) + CH3OH(l),反应吸热,但焓变的值很小。常温常压下,水解反应速率和平衡常数都较小。
HCOOH(l) + CH3OH(l),反应吸热,但焓变的值很小。常温常压下,水解反应速率和平衡常数都较小。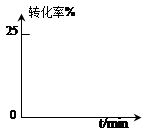

 粤公网安备 44130202000953号
粤公网安备 44130202000953号