(16分)化学反应的能量变化、速率、限度是化学研究的重要内容。
(1)有关研究需要得到C3H8(g) = 3C(石墨,s) + 4H2(g)的ΔH,但测定实验难进行。设计下图可计算得到:
①ΔH 0(填>、<或=)
②ΔH =
(用图中其它反应的反应热表示)
(2)甲酸、甲醇、甲酸甲酯是重要化工原料。它们的一些性质如下:
| 物质 |
HCOOH |
CH3OH |
HCOOCH3 |
| 主要 性质 |
无色液体,与水互溶 K(HCOOH)>K(CH3COOH) |
无色液体,与水互溶 |
无色液体,在水中溶解度小,与醇互溶 |
工业制备甲酸原理:HCOOCH3(l) + H2O(l) 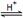 HCOOH(l) + CH3OH(l),反应吸热,但焓变的值很小。常温常压下,水解反应速率和平衡常数都较小。
HCOOH(l) + CH3OH(l),反应吸热,但焓变的值很小。常温常压下,水解反应速率和平衡常数都较小。
①工业生产中,反应起始,在甲酸甲酯和水的混合物中加入少量甲酸和甲醇,从反应速率和限度的角度分析所加甲酸和甲醇对甲酸甲酯水解的影响。
甲醇: 。
甲酸: 。
某小组通过试验研究反应HCOOCH3转化率随时间变化的趋势,在温度T1下,采用酯水比为1:2进行实验,测得平衡是HCOOCH3的转化率为25%。
②预测HCOOCH3转化率随时间的变化趋势并画图表示。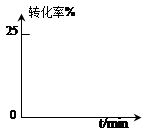
③该反应在温度T1下的平衡常数K= 。
(保留两位有效数字)
(3)HCOOH成为质子膜燃料电池的燃料有很好的发展前景。
写出该燃料电池的电极反应式:
。
 粤公网安备 44130202000953号
粤公网安备 44130202000953号