(1)按官能团的不同,可以对有机物进行分类,请指出下列有机物的种类:
①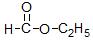 _________;②
_________;②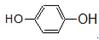 ________。
________。
(2)用系统命名法给下列有机物命名:
①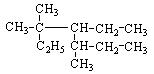 ;②
;②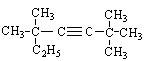 。
。
(3)写出由电石制聚氯乙烯的化学方程式: 。
(1)按官能团的不同,可以对有机物进行分类,请指出下列有机物的种类:
①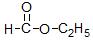 _________;②
_________;② ________。
________。
(2)用系统命名法给下列有机物命名:
① ;②
;②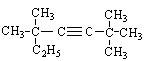 。
。
(3)写出由电石制聚氯乙烯的化学方程式: 。