煤化工中常需研究不同温度下平衡常数、投料比及热值等问题
已知:CO(g)+H2O(g) H2(g)+CO2(g)的平衡常数随温度变化如下表:
H2(g)+CO2(g)的平衡常数随温度变化如下表:
| 温度/℃ |
400 |
500 |
800 |
| 平衡常数Kc |
9.94 |
9 |
1 |
试回答下列问题
(1)上述逆反应是: 反应(选填:“放热”、“吸热”)。
(2)在800℃发生上述反应,以表中的物质的量投入恒容反应器,其中向正反应方向移动的有 (选填A、B、C、D、E)。
| |
A |
B |
C |
D |
E |
| n(CO2) |
3 |
1 |
0 |
1 |
1 |
| n(H2) |
2 |
1 |
0 |
1 |
2 |
| n(CO) |
1 |
2 |
3 |
0.5 |
3 |
| n(H2O) |
5 |
2 |
3 |
2 |
1 |
(3)已知在一定温度下:C(s)+CO2(g)  2CO(g)平衡常数K;
2CO(g)平衡常数K;
C(s) + H2O(g)  CO(g)+H2(g) 平衡常数K1;
CO(g)+H2(g) 平衡常数K1;
CO(g)+H2O(g) H2(g)+CO2(g) 平衡常数K2 。
H2(g)+CO2(g) 平衡常数K2 。
则K、K1、K2之间的关系是: 
(4)在VL密闭容器中通入10molCO和10mol水蒸气,在T℃达到平衡,然后急速除去水蒸气(除水蒸气时各物质的物质的量不变),将混合气体燃烧,测得放出的热量为2842kJ(已知CO燃烧热为283kJ/mol,H2燃烧热为286kJ/mol),则T℃平衡常数K= 。
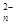


 ,计算结果保留小数点后1位)
,计算结果保留小数点后1位)
 粤公网安备 44130202000953号
粤公网安备 44130202000953号