A、B、C是在中学化学中常见的三种化合物,它们各由两种无素组成,甲、乙是两种单质。这些化合物和单质之间存在如下的关系:
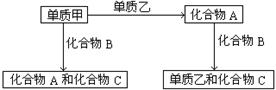
据此判断:(1)在A、B、C这三种化合物中,必定含有乙元素的是 (用A、B、C字母填写)。
(2)单质乙必定是 (填“金属”或“非金属”),其理由是 。
(3)单质乙的化学式可能是 ,则化合物B的化学式是 。
A、B、C是在中学化学中常见的三种化合物,它们各由两种无素组成,甲、乙是两种单质。这些化合物和单质之间存在如下的关系:

据此判断:(1)在A、B、C这三种化合物中,必定含有乙元素的是 (用A、B、C字母填写)。
(2)单质乙必定是 (填“金属”或“非金属”),其理由是 。
(3)单质乙的化学式可能是 ,则化合物B的化学式是 。