已知:a、H+(aq) + OH-(aq) = H2O(l) △H=-57.3 kJ•mol-1;
b、1.6gCH4完全燃烧生成水蒸气时放热80.2kJ,1g水蒸气转化成液态水放热2.444kJ。
(1)氢氧化钠与硫酸两稀溶液发生反应,写出表征其中和热的热化学方程式:
(2)写出表征甲烷燃烧热的热化学方程式:
(3)已知2SO2(g)+O2(g)  2SO3(g)反应过程的能量变化如图所示。请回答下列问题:
2SO3(g)反应过程的能量变化如图所示。请回答下列问题: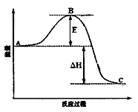
①图中C表示 E的大小对该反应的反应热有无影响? 。
②该反应通常用V2O5作催化剂,加V2O5会使图中B点升高还是降低? ,理由是 ;
(4)盖斯定律在生产和科学研究中有很重要的意义。有些反应的反应热虽然无法直接测得,但可通过间接的方法测定。现根据下列3个热化学反应方程式:
①Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) △H=―24.8 kJ•mol-1
② 3Fe2O3(s)+ CO(g)=2Fe3O4(s)+ CO2(g) △H=―47.2 kJ•mol-1
③Fe3O4(s)+CO(g)=3FeO(s)+CO2(g) △H= +640.5 kJ•mol-1
写出CO气体还原FeO固体得到Fe固体和CO2气体的热化学反应方程式:
_________________________________________________。

 粤公网安备 44130202000953号
粤公网安备 44130202000953号