m、n、x、y四种主族元素在周期表里的相对位置如右图所示。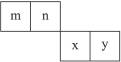
已知它们的原子序数总和为46,则:
(1)元素n的气态氢化物的化学式为__________。
(2)y的单质通入石灰乳中所生成的具有漂白性,其漂白原理是__________________(用化学方程式表示)。
(3)x的原子结构示意图为___________________________________。
(4)检验y的-1价阴离子的离子方程式为____________________________。
m、n、x、y四种主族元素在周期表里的相对位置如右图所示。
已知它们的原子序数总和为46,则:
(1)元素n的气态氢化物的化学式为__________。
(2)y的单质通入石灰乳中所生成的具有漂白性,其漂白原理是__________________(用化学方程式表示)。
(3)x的原子结构示意图为___________________________________。
(4)检验y的-1价阴离子的离子方程式为____________________________。