盖尔达法分解蛋白质的过程可表示为:蛋白质 硫酸铵
硫酸铵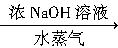 氨
氨
现对牛奶中的蛋白质进行下列实验。取30.0 mL牛奶用盖尔达法分解蛋白质,把氮完全转化成氨,用0.5 mol·L-1 H2SO4 50.0 mL吸收后,剩余的酸用1 mol·L-1 NaOH溶液中和,需38.0 mL。求:
(1)30.0 mL牛奶中共含有多少克氮?
(2)如果蛋白质中含氮16%(质量分数),则牛奶中含蛋白质的质量分数是多少?(已知牛奶的密度是1.03 g·mL-1)
盖尔达法分解蛋白质的过程可表示为:蛋白质 硫酸铵
硫酸铵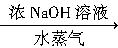 氨
氨
现对牛奶中的蛋白质进行下列实验。取30.0 mL牛奶用盖尔达法分解蛋白质,把氮完全转化成氨,用0.5 mol·L-1 H2SO4 50.0 mL吸收后,剩余的酸用1 mol·L-1 NaOH溶液中和,需38.0 mL。求:
(1)30.0 mL牛奶中共含有多少克氮?
(2)如果蛋白质中含氮16%(质量分数),则牛奶中含蛋白质的质量分数是多少?(已知牛奶的密度是1.03 g·mL-1)