使用某些有机物材料给环境造成的“白色污染”后果严重。最近研究的一些分解性塑料,有良好的生物适应性和分解性,能自然腐烂分解。如: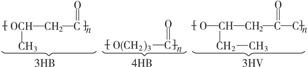
已知3HB的单体叫3-羟基丁酸,则:
(1)4HB的单体名称是_______________,3HV的单体名称是_______________;
(2)两分子4HB的单体脱水时,生成的环酯的结构简式为_______________。
使用某些有机物材料给环境造成的“白色污染”后果严重。最近研究的一些分解性塑料,有良好的生物适应性和分解性,能自然腐烂分解。如:
已知3HB的单体叫3-羟基丁酸,则:
(1)4HB的单体名称是_______________,3HV的单体名称是_______________;
(2)两分子4HB的单体脱水时,生成的环酯的结构简式为_______________。