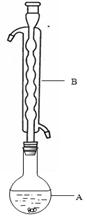
用50 mL 0.50 mol · L-1的盐酸与50 mL 0.55 mol · Lf-1的氢氧化钠溶液在如下图所示的装置中进行中和反应,通过测定反应过程中所放出的热量可计算中和热。完成下列问题:
(1)烧杯间填满碎泡沫塑料的作用是__________________;
(2)环形玻璃搅拌棒能否用环形铁质搅拌棒代替?______(填“能”或“不能”),其原因是___________________________________;

(3)为什么氢氧化钠溶液的浓度要用0.55 mol · L-1?___________________________;
实验中若改用60 mL 0.50 mol · L-1的盐酸与50 mL 0.55 mol · L-1的氢氧化钠溶液进行反应,与上述实验相比,所放出的热量_________(填“相等”“不相等”),若实验操作均正确,则所求中和热_________(填“相等”“不相等”);
(4)已知在稀溶液中,强酸和强碱发生中和反应生成1 mol H2O时,放出57.3 kJ的热量,则上述反应的热化学方程式为:_____________________________;
(5)若某同学利用上述装置做实验,有些操作不规范,造成测得的结果偏低,请你分析结果偏低的原因可能是_________(填字母代号)。
a.测量盐酸的温度后,温度计没有用水冲洗干净
b.把量筒中的氢氧化钠溶液倒入小烧杯时动作迟缓
c.做本实验的当天室温较高
d.将50 mL 0.55 mol · L-1的氢氧化钠溶液取成了50 mL 0.55 mol · L-1的氨水
e.在量取盐酸时仰视读数
f.大烧杯的盖板中间小孔太大







 粤公网安备 44130202000953号
粤公网安备 44130202000953号