某实验小组用0.50 mol/L NaOH溶液和0.50 mol/L硫酸溶液进行中和热的测定。
Ⅰ.配制0.50 mol/L NaOH溶液
(1)若实验中大约要使用245 mL NaOH溶液,至少需要称量NaOH固体 g。
(2)配制过程中需要用到的玻璃仪器除烧杯、玻璃棒外还需要有 、 。
Ⅱ.测定中和热的实验装置如下图所示。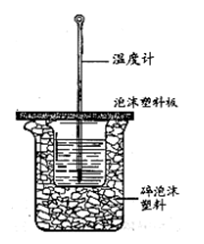
(3)大小烧杯之间填满碎泡沫塑料的作用是 ,从实验装置上看,图中缺少的一种玻璃仪器 。
(4)使用补全仪器后的装置进行实验,取50mL 0.25mol/L H2SO4溶液与50mL0.55 mol/L NaOH溶液在小烧杯中进行中和反应,实验数据如下表。
①请填写下表中的空白:
| 实验次数 |
起始温度t1/℃ |
终止温度 t2/℃ |
温度差平均值 (t2-t1)/℃ |
||
| H2SO4 |
NaOH |
平均值 |
|||
| 1 |
26.2 |
26.0 |
26.1 |
29.5 |
℃ |
| 2 |
27.0 |
27.4 |
27.2 |
33.3 |
|
| 3 |
25.9 |
25.9 |
25.9 |
29.2 |
|
| 4 |
26.4 |
26.2 |
26.3 |
29.8 |
②通过计算可得中和热△H= (精确到小数点后一位)
③上述实验数值结果与57.3 kJ/mol有偏差,产生偏差的原因可能是 。(填字母)
A.实验装置保温、隔热效果差
B.量取NaOH溶液的体积时仰视读数
C.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
D.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
(5)实验中若用60mL0.25mol·L-1H2SO4溶液跟50mL0.55mol·L-1NaOH溶液进行反应,与上述实验相比,所放出的热量 (填“相等”、“不相等”),所求中和热 (填“相等”、“不相等”);若用50mL0.50mol·L-1醋酸代替H2SO4溶液进行上述实验,测得反应前后温度的变化值会 (填“偏大”、“偏小”、“不受影响”)。

 H2NCOONH4(s)ΔH<0
H2NCOONH4(s)ΔH<0
 粤公网安备 44130202000953号
粤公网安备 44130202000953号