将一定浓度的硝酸钠和氯化钾的混合溶液加热至沸腾,有晶体析出,趁热过滤,分离出晶体A,将上述滤液冷却至室温,又有晶体B析出(有关物质的溶解度表见下表)。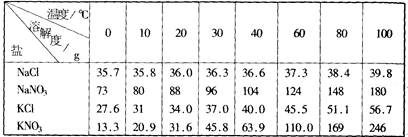
①A的主要成分是 ,含有的杂质是 。
②B的主要成分是 ,含有的杂质是
③用少量热水淋洗晶体也是除杂的一种方法,该方法适用对晶体 除杂(填“A”或“B”),提纯另外一种晶体的方法常用
④“加热至沸腾,有晶体析出”所需要的实验仪器主要有 ,“趁热过滤”常采取的方法是
将一定浓度的硝酸钠和氯化钾的混合溶液加热至沸腾,有晶体析出,趁热过滤,分离出晶体A,将上述滤液冷却至室温,又有晶体B析出(有关物质的溶解度表见下表)。
①A的主要成分是 ,含有的杂质是 。
②B的主要成分是 ,含有的杂质是
③用少量热水淋洗晶体也是除杂的一种方法,该方法适用对晶体 除杂(填“A”或“B”),提纯另外一种晶体的方法常用
④“加热至沸腾,有晶体析出”所需要的实验仪器主要有 ,“趁热过滤”常采取的方法是