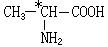 有机分子中碳原子连接四个不同的原子或原子团时,称为不对称碳原子(或手性碳原子),以*C表示,具有手性碳原子的有机物具有光学活性。如
有机分子中碳原子连接四个不同的原子或原子团时,称为不对称碳原子(或手性碳原子),以*C表示,具有手性碳原子的有机物具有光学活性。如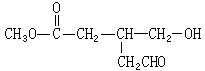 ①标出下列有机物X中的手性碳原子:
①标出下列有机物X中的手性碳原子:
②若使有机物X通过化学变化,使生成物中不再具有手性碳原子从而失去光学活性,可能发生的反应类型有___________________。(只限一步转化)
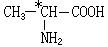 有机分子中碳原子连接四个不同的原子或原子团时,称为不对称碳原子(或手性碳原子),以*C表示,具有手性碳原子的有机物具有光学活性。如
有机分子中碳原子连接四个不同的原子或原子团时,称为不对称碳原子(或手性碳原子),以*C表示,具有手性碳原子的有机物具有光学活性。如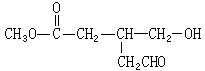 ①标出下列有机物X中的手性碳原子:
①标出下列有机物X中的手性碳原子:
②若使有机物X通过化学变化,使生成物中不再具有手性碳原子从而失去光学活性,可能发生的反应类型有___________________。(只限一步转化)