(8分)在某温度下,将 和
和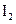 各0.1mol的气态混合物充入10L的密闭容器中,充分反应,连续测定
各0.1mol的气态混合物充入10L的密闭容器中,充分反应,连续测定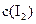 的变化,5S时测定
的变化,5S时测定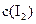 =0.0080mol/L并保护不变。
=0.0080mol/L并保护不变。
(1)反应在达到平衡过程中, 的平均消耗速率为 mol/L·S;
的平均消耗速率为 mol/L·S;
(2)反应的平衡常数的表达式是 = ;
= ;
(3)此温度下,平衡常数值为 ;
(4)若在此温度下,在10L的密闭器充入0.2molHI气体,达到平衡时,HI的转化率为 。

 2SO3,的平衡常数K=19,在该温度下的体积
2SO3,的平衡常数K=19,在该温度下的体积 固定的密闭容器中充
固定的密闭容器中充 2SO3(g) ΔH=-196.6 kJ·mol-1
2SO3(g) ΔH=-196.6 kJ·mol-1

 CO2(g) ΔH=E1 ①
CO2(g) ΔH=E1 ① _____(填“大于”、“等于”、“小于”)途径II放出的热量。
_____(填“大于”、“等于”、“小于”)途径II放出的热量。 是_____________________________________。
是_____________________________________。
 代基有—R(烷基)、—NH2等;使新取代基进入间位的取代基有—COOH、—NO2等;
代基有—R(烷基)、—NH2等;使新取代基进入间位的取代基有—COOH、—NO2等; 粤公网安备 44130202000953号
粤公网安备 44130202000953号