I、(1)三种弱酸HA、H2B、HC,电离平衡常数的数值为1.8×10-5、5.6×10-11、4.9×10-10、4.3×10-7(数据顺序已打乱),已知三种酸和它们的盐之间能发生以下反应:①HA + HB- (少量)=A_ + H2B ,②H2B(少量) + C- = HB_ + HC ,③HA(少量) + C- =A_ + HC 。则三种酸对应的电离平衡常数分别为(请填空)
|
HA
|
H2B
|
HC
|
Ka
|
Ka1
|
Ka2
|
Ka3
|
Ka4
|
数值
|
|
|
|
|
(2)常温下0.1mol/LCH3COOH溶液加水稀释过程,下列表达式数据一定变小是:_______
A c(H+) B c(H+)/c(CH3COOH) C c(H+)·c(OH-)
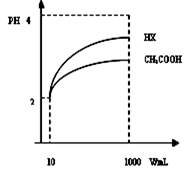
Dc(OH-)/(H+)体积为10mLpH=2醋酸溶液与一元酸HX分别加水稀释至1000mL,稀释过程pH变化如图:则HX电离平衡常数_____(填大于、等于或小于)醋酸平衡常数;理由是___________________________
II、工业废水中常含有一定量的Cr2O72-和CrO42-,它们会对人体及生态系统产生很大的伤害,必须进行处理。还原沉淀法是常用的一种方法。
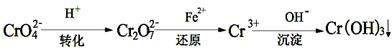
(1)转化过程中存在平衡2CrO42- + 2H+ Cr2O72- + H2O能说明反应到达平衡状态的是
Cr2O72- + H2O能说明反应到达平衡状态的是
A.CrO42-和Cr2O72-的浓度相同 B.2ν(Cr2O72-)=ν(CrO42-)
C.溶液的pH值保持不变 D.溶液颜色保持不变
(2)若1L转化后所得溶液中含铬元素质量为28.6g,CrO42-有10/11转化为Cr2O72-(已知铬元素相对原子质量为52)。①转化后所得溶液中c(Cr2O72-)=
②已知:常温下该反应的平衡常数K=1014,上述转化后所得溶液的pH为
(3)还原过程中的离子反应方程式
(4)若常温下Ksp(Cr(OH)3)=10-32,要使c(Cr3+)降至10-5mol/L,溶液的pH应调至