水是最常用的溶剂,许多化学反应都需要在水溶液中进行。请仔细分析并回答下列各题。
(1)用0.1mol/LNaOH溶液滴定体积均为20.00mL、浓度均为0.1mol/L盐酸和醋酸溶液,得到如下所示滴定曲线图:
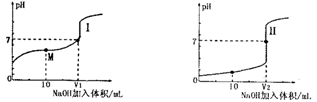
①用NaOH 溶液滴定醋酸溶液通常所选择的指示剂为________,符合其滴定曲线的是_______(填“I”或“II”);
②滴定前的上述三种溶液中,由水电离出的c(H+)最大的是_________溶液(填化学式);
③图中v1和v2大小的比较:v1_______v2 (填“>”、“<”或“=”);
④图I中M 点对应的溶液中,各离子的浓度由大到小的顺序是______________。
(2)某同学为了研究难溶电解质的溶解平衡,设计了如下实验(相关数据测定温度及实验环境均为25 ℃ ):
操作步骤
|
现象
|
步骤1:向20mL0.05mol/LAgNO3溶液中加入20mL0.05mol/LKSCN溶液,充分反应后过滤
|
出现白色沉淀
|
步骤2:向滤液中加少量2mol/LFe(NO3)3溶液
|
溶液变红色
|
步骤3:向步骤2所得溶液中,加入少量3mol/LAgNO3溶液
|
现象a
|
步骤4:取步骤1所得少量滤渣加入到适量的3mol/LKI溶液中
|
出现黄色沉淀
|
查阅资料:AgSCN是白色沉淀:Ksp(AgSCN)=1.0×10-12;Ksp(AgI)=8.5×10-17.
① 请结合化学用语和必要的文字解释步骤2 现象出现的原因:____________________。
②该同学根据步骤3中现象a推知,加入的AgNO3与步骤2所得溶液发生了反应,则现象a为______________(任写一点即可)。
③ 写出步骤4 中沉淀转化反应平衡常数的表达式:K=__________。