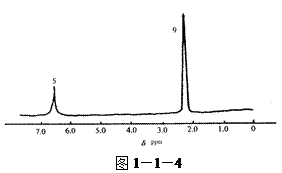
由分子式及核磁共振氢谱写出该有机物的结构简式(图1—1—3)、(图1—1—4)
|
|
强度比:1∶3 强度比:5∶9
 |
|||
 |
|||
答案(1)
(2)
①结构简式:________________________ ②结构简式:________________________

由分子式及核磁共振氢谱写出该有机物的结构简式(图1—1—3)、(图1—1—4)
|
|
强度比:1∶3 强度比:5∶9
 |
|||
 |
|||
答案(1)
(2)
①结构简式:________________________ ②结构简式:________________________
