如果我们规定12C的相对原子质量为24,且0.024kg12C中所含的原子个数为阿伏加德罗常数(NA),那么下列几种物理量会有变化吗?若有,请说明变化结果。 (1)一个12C原子的质量 (2)阿伏加德罗常数(NA) (3)摩尔质量
(1)一个12C原子的质量 (2)阿伏加德罗常数(NA) (3)摩尔质量 (4)O2的相对分子质量 (5)气体摩尔体积
(4)O2的相对分子质量 (5)气体摩尔体积  (6)98%(
(6)98%(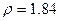 )硫酸的物质的量浓度 (7)44gCO2所含的分子个数
)硫酸的物质的量浓度 (7)44gCO2所含的分子个数
如果我们规定12C的相对原子质量为24,且0.024kg12C中所含的原子个数为阿伏加德罗常数(NA),那么下列几种物理量会有变化吗?若有,请说明变化结果。 (1)一个12C原子的质量 (2)阿伏加德罗常数(NA) (3)摩尔质量
(1)一个12C原子的质量 (2)阿伏加德罗常数(NA) (3)摩尔质量 (4)O2的相对分子质量 (5)气体摩尔体积
(4)O2的相对分子质量 (5)气体摩尔体积  (6)98%(
(6)98%(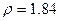 )硫酸的物质的量浓度 (7)44gCO2所含的分子个数
)硫酸的物质的量浓度 (7)44gCO2所含的分子个数