[上海]2012届上海市崇明县高三高考模拟考试(二模)化学试卷
2012年2月,国务院同意发布新修订的《环境空气质量标准》增加了PM2.5监测指标。PM2.5是指大气中直径小于或等于2.5微米的可吸入肺颗粒物,对人体伤害很大。PM2.5来源广泛,下列不可能是PM2.5来源的是( )
| A.风扬尘土 | B.汽车尾气 | C.餐饮油烟 | D.水力发电 |
下列实验过程中,始终无明显现象的是( )
A. 通入 通入 溶液中 溶液中 |
B. 通入 通入 溶液中 溶液中 |
C. 通入 通入 溶液中 溶液中 |
D. 通入溴水中 通入溴水中 |
将铜丝烧热,迅速插入氢气中,发生反应: 。若用下列物质代替氢气进行上述实验:①一氧化碳、②稀硝酸、③稀盐酸、④乙醇,铜丝表面所观察到的现象、铜丝质量变化情况与上述实验完全相同的是( )
。若用下列物质代替氢气进行上述实验:①一氧化碳、②稀硝酸、③稀盐酸、④乙醇,铜丝表面所观察到的现象、铜丝质量变化情况与上述实验完全相同的是( )
| A.①②③ | B.①④ | C.①③④ | D.只有① |
下列有关化学用语表达正确的是( )
A.Cl 的最外层电子排布式: 的最外层电子排布式: |
B.聚丙烯的结构简式: CH2-CH2-CH2 CH2-CH2-CH2 |
| C.CH2Br2只能表示一种物质 |
D.NH3的电子式: |
下列溶液中能用来区别SO2和CO2气体的是( )
①澄清的石灰水 ②氯水 ③酸性高锰酸钾溶液 ④氯化钡溶液 ⑤品红溶液
| A.①④⑤ | B.②③⑤ | C.①②③ | D.②③④ |
根据以下三个热化学方程式:
2H2S(g)+3O2(g) → 2SO2(g)+2H2O(1)+akJ
2H2S(g)+O2(g) → 2S(s)+2H2O(1)+bkJ
2H2S(g)+O2(g) → 2S(s)+2H2O(g)+ckJ(a、b、c均为正数)
对a、b、c三者大小关系的判断正确的是( )
| A.a>b>c | B.a>c>b | C.c>b>a | D.b>a>c |
常温下,下列各组离子在指定溶液中能大量共存的是( )
A.pH=1的溶液中:Fe 、NO 、NO 、SO 、SO 、Na 、Na |
B.由水电离的c(H ) ) mol/L的溶液中:Ca mol/L的溶液中:Ca 、K 、K 、Cl 、Cl 、HCO 、HCO |
C.c(H )/c(OH )/c(OH ) ) 的溶液中:NH 的溶液中:NH 、Al 、Al 、NO 、NO 、Cl 、Cl |
D.c(Fe ) ) mol/L的溶液中:K mol/L的溶液中:K 、ClO 、ClO 、SO 、SO 、SCN 、SCN |
双氧水可作为采矿业废液的处理剂,如用来消除采矿废液中的氰化物,反应方程式如下:KCN H2O2
H2O2 H2O → A
H2O → A NH3↑。下列说法正确的是( )
NH3↑。下列说法正确的是( )
| A.生成物A是一种正盐 | B.氨气是还原产物 |
| C.该反应中H2O2作氧化剂 | D.处理 mol KCN转移 mol KCN转移 mol电子 mol电子 |
如图所示,集气瓶内充满某混合气体,置于光亮处,将滴管内的水挤入集气瓶后,烧杯中的水会进入集气瓶,集气瓶内气体可能是( )
① CO、O2 ② Cl2、CH4 ③ NO2、O2 ④ N2、H2
| A.①② | B.②④ | C.③④ | D.②③ |
一定量的氢气在氯气中燃烧,所得混合物冷却后用500mL mol·L
mol·L 的NaOH溶液恰好完全吸收,测得溶液中含有NaClO的物质的量为
的NaOH溶液恰好完全吸收,测得溶液中含有NaClO的物质的量为 mol,参加反应的氢气和所用氯气的物质的量之比为( )
mol,参加反应的氢气和所用氯气的物质的量之比为( )
A. |
B. |
C. |
D. |
已知25℃时,弱电解质的电离平衡常数:Ka(CH3COOH) ,Ka(HSCN)
,Ka(HSCN) 。在物质的量浓度均为
。在物质的量浓度均为 mol·L
mol·L 的CH3COONa和NaSCN混合溶液中,下列排序正确的是( )
的CH3COONa和NaSCN混合溶液中,下列排序正确的是( )
A.c(OH )>c(CH3COOH)>c(HSCN)>c(H )>c(CH3COOH)>c(HSCN)>c(H ) ) |
B.c(OH )>c(HSCN)>c(CH3COOH)>c(H )>c(HSCN)>c(CH3COOH)>c(H ) ) |
C.c(OH )>c(SCN )>c(SCN )>c(CH3COO )>c(CH3COO )>c(H )>c(H ) ) |
D.c(OH )>c(CH3COO )>c(CH3COO )>c(SCN )>c(SCN )>c(H )>c(H ) ) |
氮化钠和氢化钠与水反应的化学方程式如下:Na3N 3H2O → 3NaOH + NH3↑,
3H2O → 3NaOH + NH3↑,
NaH H2O → NaOH
H2O → NaOH H2↑。有关Na3N和NaH的叙述正确的是( )
H2↑。有关Na3N和NaH的叙述正确的是( )
A.离子半径:Na N N H H |
B.加热熔化时,都只破坏离子键 |
| C.与盐酸反应都只生成一种盐 | D.与水反应都是氧化还原反应 |
 紫罗兰酮是存在于玫瑰花、番茄等中的一种天然香料,它经多步反应可合成维生素A1
紫罗兰酮是存在于玫瑰花、番茄等中的一种天然香料,它经多步反应可合成维生素A1
下列说法正确的是( )
A. 紫罗兰酮和中间体X都可使酸性KMnO4溶液褪色 紫罗兰酮和中间体X都可使酸性KMnO4溶液褪色 |
B. mol中间体X最多能与 mol中间体X最多能与 mol H2发生加成反应 mol H2发生加成反应 |
C. 紫罗兰酮分子式为:C13H22O 紫罗兰酮分子式为:C13H22O |
D. 紫罗兰酮与中间体X互为同分异构体 紫罗兰酮与中间体X互为同分异构体 |
出土的锡青铜(铜锡合金)文物常有Cu2(OH)3Cl覆盖在其表面。下列说法错误的是( )
| A.锡青铜的熔点比纯铜低 |
| B.在自然环境中,锡青铜中的锡对铜起保护作用 |
| C.锡青铜文物在潮湿环境中的腐蚀比干燥环境中快 |
| D.生成Cu2(OH)3Cl覆盖物是电化学腐蚀过程,但不是化学反应过程 |
将amol钠和amol铝一同放入mg水(足量)中,所得溶液的密度为dg/mL,该溶液的质量百分比浓度为( )
A. |
B. |
C. |
D. |
如图,采用NH3作还原剂,烟气以一定的流速通过两种不同催化剂,测量逸出气体中氮氧化物含量,从而确定烟气脱氮率,反应原理为:NO(g)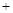 NO2(g)
NO2(g)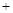 2NH3(g)
2NH3(g) 2N2(g)
2N2(g)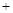 3H2O(g),相关说法正确的是 )
3H2O(g),相关说法正确的是 )
| A.上述反应的正反应为吸热反应 |
| B.催化剂①、②分别适合于250℃和450℃左右脱氮 |
| C.曲线①、②最高点表示此时平衡转化率最高 |
| D.相同条件下,改变压强对脱氮率没有影响 |
已知: ,如果要合成
,如果要合成 所用的原始原料可以是( )
所用的原始原料可以是( )
| A.2-甲基-l, 3-丁二烯和2-丁炔 | B.1, 3-戊二烯和2-丁炔 |
| C.2, 3-二甲基-1, 3-戊二烯和乙炔 | D.2, 3-二甲基-l, 3-丁二烯和丙炔 |
水是最宝贵的资源之一。下列表述正确的是( )
A.H2O的电子式为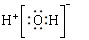 |
B.4℃时,纯水的pH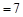 |
| C.D216O中,质量数之和是质子数之和的两倍 |
| D.273K、101kPa,水分子间的平均距离d:d(气态)>d(液态)>d(固态) |
常温下,往H2O2溶液中滴加少量FeSO4溶液,可发生如下两个反应:
2Fe H2O2
H2O2 2H
2H → 2Fe
→ 2Fe 2H2O 2Fe
2H2O 2Fe H2O2 → 2Fe
H2O2 → 2Fe O2↑
O2↑ 2H
2H
下列说法正确的是( )
A.H2O2的氧化性比Fe 强,其还原性比Fe 强,其还原性比Fe 弱 弱 |
| B.在H2O2分解过程中,溶液的pH逐渐下降 |
C.在H2O2分解过程中,Fe 和Fe 和Fe 的总量保持不变 的总量保持不变 |
D.H2O2生产过程要严格避免混入Fe |
下列反应的离子方程式书写正确的是( )
| A.将等物质的量的Ba(OH)2与明矾投入足量水中: 3Ba  6OH 6OH 2A1 2A1 3SO 3SO → 3BaSO4↓ → 3BaSO4↓ 2A1(OH)3↓ 2A1(OH)3↓ |
B.把Fe(OH)3溶于氢氟酸:Fe(OH)3 3H 3H → Fe → Fe 3H2O 3H2O |
C.向H O中投入Na2O2固体:2H O中投入Na2O2固体:2H O O 2Na2O2 → 4Na 2Na2O2 → 4Na 4OH 4OH 18O2↑ 18O2↑ |
D.在苯酚钠溶液中通入少量的二氧化碳气体:C6H5O CO2 CO2 H2O → C6H5OH H2O → C6H5OH HCO HCO |
合金(仅含铜、铁)中铜和铁的物质的量之和为y mol,其中Cu的物质的量分数为a,将其全部投入 mL bmol·L
mL bmol·L 的硝酸溶液中,加热使其充分反应(假设NO是唯一的还原产物)。下列说法正确的是( )
的硝酸溶液中,加热使其充分反应(假设NO是唯一的还原产物)。下列说法正确的是( )
| A.若金属有剩余,在溶液中再滴入硫酸后,剩余金属一定又开始溶解 |
B.若金属全部溶解,则溶液中一定含有Fe |
C.若金属全部溶解,且产生 mL气体(标准状况),则b mL气体(标准状况),则b |
D.当溶液中金属离子只有Fe 、Cu 、Cu 时,则a与b的关系为:b≥ 时,则a与b的关系为:b≥ (1 (1 a/3) a/3) |
(共8分)下表为元素周期表的一部分,请参照元素①-⑧在表中的位置,用化学用语回答下列问题:
| |
IA |
|
|
|
|
|
|
0 |
| 1 |
① |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
|
| 2 |
|
|
|
② |
③ |
④ |
|
|
| 3 |
⑤ |
|
⑥ |
|
⑦ |
|
⑧ |
|
(1)、④、⑤、⑥的原子半径由大到小的顺序为 (填元素符号)。
②、⑦、⑧的最高价含氧酸的酸性由强到弱的顺序是 (填化学式)。
(2)、①、④、⑤、⑧四种元素中,某些元素间可形成既含离子键又含极性共价键的化合物,写出其中一种化合物的电子式: 。
(3)、由表中两种元素的原子按 组成的常见液态化合物的稀液易被催化分解,可使用的催化剂为(填序号) 。
组成的常见液态化合物的稀液易被催化分解,可使用的催化剂为(填序号) 。
a.MnO2 b.Na2SO4 c.Na2SO3 d.CaCO3
(4)、由表中元素形成的物质X、Y、Z、M、N可发生以下反应: 
X溶液与Y溶液反应的离子方程式为 ;
常温下,为使0.1 mol/L M溶液中电离出的阴、阳离子浓度相等,应向溶液中加入一定量的Y溶液至pH 。
。
(共8分) XeO3是一种不稳定的物质,具有强氧化性。
2(1)配平反应的离子方程式:
XeO3 Mn
Mn H2O → MnO
H2O → MnO Xe↑
Xe↑ H
H
(2)反应现象为:①有气泡产生,② 。
(3)发生氧化反应的物质是 。
(4)将适量的XeO3投入 mL 0.1mol·L
mL 0.1mol·L Mn
Mn 的水溶液中,刚好完全反应。
的水溶液中,刚好完全反应。
此时转移电子 mol。
将反应后的溶液稀释至90mL,所得溶液的pH 。
。
(共10分)二甲醚是一种重要的清洁燃料,也可替代氟利昂作制冷剂等,对臭氧层无破坏作用。工业上可利用焦炭与水蒸气在高温下的反应产物(水煤气)合成二甲醚。请回答下列问题:
(1)、制水煤气的主要化学反应方程式为: 。
(2)、煤的气化过程中产生的有害气体H2S用Na2CO3溶液吸收,生成两种酸式盐,该反应的化学方程式为: 。
(3)、利用水煤气合成二甲醚的三步反应如下:
① 2H2(g) CO(g)
CO(g) CH3OH(g)
CH3OH(g) 90.8 kJ
90.8 kJ
② 2CH3OH(g) CH3OCH3(g)
CH3OCH3(g) H2O(g)
H2O(g) 23.5 kJ
23.5 kJ
③ CO(g) H2O(g)
H2O(g) CO2(g)
CO2(g) H2(g)
H2(g) 41.3 kJ
41.3 kJ
总反应:3H2(g) 3CO(g)
3CO(g) CH3OCH3(g)
CH3OCH3(g) CO2(g)
CO2(g) Q,其中Q
Q,其中Q kJ;
kJ;
一定条件下的密闭容器中,该总反应达到平衡,要提高CO的转化率,可以采取的措施是
(填字母代号)。
a.低温高压 b.加入催化剂 c.减少CO2的浓度 d.增加CO的浓度
(4)、已知某温度下反应②2CH3OH(g) CH3OCH3(g)
CH3OCH3(g) H2O(g)在一密闭容器中进行到10min时恰好达平衡,测得各组分的浓度如下:
H2O(g)在一密闭容器中进行到10min时恰好达平衡,测得各组分的浓度如下:
| 物质 |
CH3OH |
CH3OCH3 |
H2O |
浓度/(mol·L ) ) |
0.44 |
0.6 |
0.6 |
比较此时正、逆反应速率数值(单位相同)的大小: (甲醇)
(甲醇)  (水)(填“>”、“<”或“=”)。
(水)(填“>”、“<”或“=”)。
反应开始时 (CH3OH)
(CH3OH) ;
;
该时间内的平均反应速率 (CH3OH)
(CH3OH) ;
;
该温度下反应的平衡常数值为 。(精确到0.01)
(共10分) 某小组同学将一定浓度NaHCO3溶液加入到CuSO4溶液中发现生成了沉淀。甲同学认为沉淀是CuCO3;乙同学认为沉淀是CuCO3和Cu(OH)2的混合物,他们设计实验测定沉淀中CuCO3的质量分数。
(1)、按照甲同学的观点,发生反应的离子方程式为 。
两同学利用下图所示装置进行测定
(2)、在研究沉淀物组成前,须将沉淀从溶液中分离并净化。具体操作依次为 、洗涤、干燥。
(3)、装置E中碱石灰的作用是 。
(4)、实验过程中有以下操作步骤:
a.关闭K1、K3,打开K2、K4,充分反应
b.打开K1、K4,关闭K2、K3,通入过量空气
c.打开K1、K3,关闭K2、K4,通入过量空气
正确的顺序是(填选项序号,下同) ;
若未进行步骤 ,将使测量结果偏低。
(5)、若沉淀样品的质量为mg,装置D的质量增加了ng,则沉淀中CuCO3的质量分数为 。
(6)、丙同学认为还可以通过测量 来测定沉淀中CuCO3的质量分数。
(共12分) 工业上以锂辉石(Li2O·Al2O3·4SiO2,含少量Ca、Mg元素)为原料生产碳酸锂。其部分工艺流程如下:
已知:① Li2O·Al2O3·4SiO2 H2SO4(浓)
H2SO4(浓) Li2SO4
Li2SO4 Al2O3·4SiO2·H2O↓
Al2O3·4SiO2·H2O↓
② 某些物质的溶解度(S)如下表所示:
| T/℃ |
20 |
40 |
60 |
80 |
 (Li2CO3)/g (Li2CO3)/g |
1.33 |
1.17 |
1.01 |
0.85 |
 (Li2SO4)/g (Li2SO4)/g |
34.2 |
32.8 |
31.9 |
30.7 |
③ 从滤渣1中分离出Al2O3的部分流程如下图所示:
(1)、请依次写出在括号内加入试剂的化学式 、 。
(2)、请依次写出方框中所得到物质的化学式 、 。
(3)、步骤Ⅰ中反应的离子方程式是 。
(4)、已知滤渣2的主要成分有Mg(OH)2和CaCO3。向滤液1中加入石灰乳的作用是(运用化学平衡原理简述) 。
(5)、向滤液2中加入饱和Na2CO3溶液,过滤后,用“热水洗涤”的原因是
。
(6)、氧化铝在工业上用作高温耐火材料,制耐火砖、坩埚、瓷器、人造宝石等,同时氧化铝也是炼铝的原料。写出用氧化铝炼铝的化学方程式: 。
(共8分) 有机物A为绿色荧光蛋白在一定条件下水解的最终产物之一,结构简式为
请回答下列问题:
(1)、关于A的性质推断错误的是 ;
a.A既能和酸反应又能和碱反应 b.A不能发生加成反应
c.A可以发生氧化反应 d.A不能通过缩聚反应得到高分子化合物
(2)、A与氢氧化钠溶液反应的化学方程式为 ;
(3)、符合下列4个条件A的同分异构体有 种;
① 1,3,5-三取代苯; ② 遇氢氧化铁溶液显紫色;
③ 氨基与苯环直接相连; ④ 属于酯类
(4)、写出符合上述题意的任意一种A的同分异构体的结构简式 。
共12分) 下图中,A为芳香化合物,苯环上有两个邻位取代基:
请回答:
(1)、B所含的官能团的名称是
(2)、反应C→D的化学方程式是
反应类型是
(3)、A的结构简式是 、E的结构简式是
(4)、C在一定条件下可生成一种高分子化合物H,请写出C→H的化学方程式:
。
(5)、 mol G的溶液可跟 mo1CO2反应
mol G的溶液可跟 mo1CO2反应
(6)、B有多种同分异构体,写出属于酯类且能发生银镜反应的同分异构体的结构简式
。
(共16分) 硫化钠是用于皮革鞣制的重要化学试剂,可用无水芒硝(Na2SO4)与炭粉在高温下反应而制得,反应式如下:
① Na2SO4 4C
4C Na2S
Na2S 4CO↑
4CO↑
② Na2SO4 4CO
4CO Na2S
Na2S 4CO2
4CO2
(1)、现要制取Na2S 7.80 g,若生产过程中无水芒硝(Na2SO4)的利用率为90%,则理论上需要无水芒硝(Na2SO4) g(精确到0.01);
(2)、若在反应中生成的Na2S物质的量为1 mol,则消耗的碳单质的物质的量n的范围是
<n< ;
(3)、若在上述反应中消耗的碳单质为1 mol,生成Na2S的物质的量为 y mol,生成的CO和CO2的物质的量之比为x,则y与x的关系式为y ;
;
(4)、Na2S放置在空气中,会缓慢氧化成Na2SO3及Na2SO4,现称取已经部分氧化的硫化钠样品39.20 g溶于水中,加入足量硫酸,充分反应后,过滤得沉淀9.6 g,放出H2S气体1.12 L(标准状况)。请计算:39.20 g样品中各成分的物质的量分别为 。
(请写出计算过程)

 粤公网安备 44130202000953号
粤公网安备 44130202000953号