(共8分) XeO3是一种不稳定的物质,具有强氧化性。
2(1)配平反应的离子方程式:
XeO3 Mn
Mn H2O → MnO
H2O → MnO Xe↑
Xe↑ H
H
(2)反应现象为:①有气泡产生,② 。
(3)发生氧化反应的物质是 。
(4)将适量的XeO3投入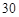 mL 0.1mol·L
mL 0.1mol·L Mn
Mn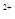 的水溶液中,刚好完全反应。
的水溶液中,刚好完全反应。
此时转移电子 mol。
将反应后的溶液稀释至90mL,所得溶液的pH 。
。
(共8分) XeO3是一种不稳定的物质,具有强氧化性。
2(1)配平反应的离子方程式:
XeO3 Mn
Mn H2O → MnO
H2O → MnO Xe↑
Xe↑ H
H
(2)反应现象为:①有气泡产生,② 。
(3)发生氧化反应的物质是 。
(4)将适量的XeO3投入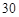 mL 0.1mol·L
mL 0.1mol·L Mn
Mn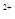 的水溶液中,刚好完全反应。
的水溶液中,刚好完全反应。
此时转移电子 mol。
将反应后的溶液稀释至90mL,所得溶液的pH 。
。