[吉林]2011-2012学年吉林省油田高中高一下学期期初考试化学试卷
已知反应X+Y=M+N为放热反应,对该反应的下列说法中正确的是
| A.X的能量一定高于M |
| B.Y的能量一定高于N |
| C.X和Y的总能量一定高于M和N的总能量 |
| D.因该反应为放热反应,故不必加热就可发生 |
元素化学性质发生周期变化性质变化的根本原因是
| A.元素的原子半径呈周期性的变化 |
| B.元素的化合价呈现周期性变化 |
| C.元素原子核外电子排布呈现周期性变化 |
| D.元素的金属性和非金属性呈周期性变化 |
下列关于化学用语的表述正确的是
A.原子核内有8个中子的碳原子 |
B.过氧化氢的电子式 |
| C.HClO的结构式为H—O—Cl |
D.硫原子的原子结构示意图 |
下列反应中,生成物的总能量高于反应物的总能量且属于氧化还原反应的是
| A.Ba(OH)2·8H2O与NH4Cl反应 | B.铝与稀盐酸 |
| C.灼热的炭与CO2反应 | D.甲烷与O2的燃烧反应 |
下列说法不正确的是
| A.化学反应除了生成新物质外,一定伴随着能量变化 |
| B.需要加热才能发生的反应不一定是吸热反应 |
| C.焓变的符号是△H,单位是kJ/mol,反应热的单位是kJ |
| D.化学反应的实质是旧键断裂和新键生成 |
下列叙述中,正确的是
| A.39K+和40Ca2+微粒中的电子数不相等而中子数相等 |
| B.D2和He在同温同压时,若体积相等,则质量相等 |
| C.同一元素的各种同位素的物理性质、化学性质均相同 |
| D.两个质子数和电子数都相等的微粒一定是同种元素 |
下列关于化学键的说法正确的是
| A.构成单质分子的微粒一定含有共价键 |
| B.由非金属元素组成的化合物不一定是共价化合物 |
| C.金属元素与非金属元素形成的化学键一定是离子键 |
| D.不同元素组成的多原子分子里的化学键一定是极性键 |
10、能源可划分为一级能源和二级能源,自然界直接提供的能源为一级能源,需要消耗其它能源的能量间接获取的能源称为二级能源。下列关于能源的说法正确的是
C.电能是一级能源 D.煤气是一级能源
下列关于原电池的叙述中,正确的是
| A.构成原电池的正极和负极必须是两种不同的金属 |
| B.原电池是将电能转化为化学能的装置 |
| C.在原电池中,电子流出的一极是负极,发生氧化反应 |
| D.原电池放电时,电流的方向是从负极到正极 |
关于热化学方程式,下列说法错误的是
| A.热化学方程式各物质前的化学计量数不表示分子个数只代表物质的量 |
| B.热化学方程式未注明温度和压强时,ΔH表示标准状况下的数据 |
| C.同一化学反应,化学计量数不同,ΔH不同;化学计量数相同而状态不同,ΔH也不相同 |
| D.化学反应过程所吸收或放出的热量与参加反应的物质的物质的量成正比 |
下列事实不能说明X元素比Y元素的非金属性强的是
| A.与H2化合时X单质比Y单质容易 |
| B.X的最高价氧化物的水化物的酸性比Y的最高价氧化物的水化物的酸性强 |
| C.X原子的最外层电子数比Y原子的最外层电子数多 |
| D.X单质可以把Y从其氢化物中置换出来 |
下列热化学方程式书写正确的是( 的绝对值均正确)
的绝对值均正确)
| A.C2H5OH(l)+3O2(g)==2CO2(g)+3H2O(g);△H=" —1367.0" kJ/mol(燃烧热) |
| B.NaOH(aq)+HCl(aq)==NaCl(aq)+H2O(l);△H=" +" 57.3kJ/mol(中和热) |
| C.P(s)+ 3/2 Cl2(g)="==" PCl3(g);△H=" —306" kJ/mol(反应热) |
| D.2NO2==O2+2NO;△H=" +" 116.2kJ/mol(反应热) |
已知1~18号元素的离子aW3+、bX+、cY2-、dZ-都具有相同的电子层结构,下列关系正确的是
| A.质子数:c>d | B.离子的还原性:Y2->Z- |
| C.氢化物的稳定性:H2Y>HZ | D.原子半径:X<W |
下列结论是从某同学的作业本上摘录的,其中你认为肯定正确的是
①微粒半径:S2->Cl->Na+ >Al3+②氢化物的稳定性:HF>HCl>H2S>H2Se ③氧化性:Cl2>S>Se>Te④酸性:H2SO4>HClO4>H2SeO4⑤得电子能力:F>Cl>Br>I
| A.只有① | B.①②③⑤ | C.①②④ | D.只有⑤ |
CO2气体在一定条件下可与金属镁反应,干冰在一定条件下可以形成CO2气体,这两个变化过程中CO2需要克服的作用分别是
| A.共价键,共价键 | B.共价键,分子间作用力 |
| C.分子间作用力,共价键 | D.分子间作用力,分子间作用力 |
下表中的数据是破坏1 mol物质中的化学键所消耗的能量(kJ):
| 物质 |
Cl2 |
Br2 |
I2 |
H2 |
| 键能/kJ·mol-1 |
243 |
200 |
151 |
436 |
下列物质本身具有的能量最低的是
A.H2 B.Cl2 C.Br2 D.I2
X、Y、Z三种短周期元素在周期表中的位置如图,X通过共用三对电子形成X2分子,下列说法不正确的是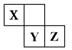
| A.化合物XZ3中各原子均满足8电子的稳定结构 |
| B.X、Y、Z三种元素形成的含氧酸都是强酸 |
| C.常温下,Z单质可与Y的氢化物发生置换反应 |
| D.一定条件下,X2与Al反应得到AlX |
以下关于锂、钠、钾、铷、铯的叙述不正确有几项
①氢氧化物中碱性最强的是CsOH
②单质熔点最高的是铯
③与O2反应均可得到多种氧化物
④它们的密度依次增大,均要保存在煤油中
⑤其单质的还原性依次增强
⑥它们对应离子的氧化性依次增强
| A.2项 | B.3项 | C.4项 | D.5项 |
相关数据如下表:
| |
H2(g) |
Br2(g) |
HBr(g) |
| 1mol分子中的化学键断裂时需要吸收的能量/kJ |
436 |
200 |
369 |
则已知H2(g) + Br2(g) =" 2HBr" (g)△H 为
A.△H =" +" 102kJ/mol B.△H =" -" 102kJ/mol
C.△H =" +" 267kJ/mol D.△H =" -" 267kJ/mol
同族元素所形成的同一类型的化合物,其结构和性质往往相似。化合物PH4I是一种白色晶体,下列对它的描述中正确的是
| A.它是一种共价化合物 |
| B.在加热时此化合物可以分解为PH3和HI |
| C.这种化合物不能跟碱反应 |
| D.该化合物可以由PH3和HI化合而成 |
已知常温时红磷比白磷稳定,在下列反应中:
P4(白磷,s)+5O2(g)=P4O10(s) ΔH=-a kJ/mol
4P(红磷,s)+5O2(g)=P4O10(s) ΔH=-b kJ/mol
若a、b均大于零,则a和b的关系为
| A.a<b | B.a=b | C.a>b | D.无法确定 |
将甲醇蒸气转化为氢气的两种反应原理是
①CH3OH(g)+H2O(g)=CO2(g)+3H2(g); △H=" +" 49.0 kJ·mol-1
②CH3OH(g)+1/2O2(g)=CO2(g)+2H2(g);△H= -192.9 kJ·mol-1
下列说法正确的是
| A.CH3OH的燃烧热为192.9 kJ·mol-1 |
| B.反应①中的能量变化如上图所示 |
| C.CH3OH转变成H2的过程一定要吸收能量 |
| D.根据②推知反应:CH3OH(l)+1/2O2(g)=CO2(g)+2H2(g)的△H>-192.9 kJ/mol |
元素周期表有________个横行,叫周期,每一周期中元素原子的 ________相同,从左到右元素的金属性依次________(填增强或减弱);元素周期表中有________个纵行,第ⅥA族处在第________纵行,同一主族从上到下,元素的非金属性依次________(填增强或减弱)。
依据叙述,写出下列反应的热化学方程式。
①在25℃、101 kPa下,32g甲醇(CH3OH)的燃烧放出的热量为725.8kJ,则表示甲醇燃烧热的热化学方程式为(已知常温下甲醇为液态)
______________________________________________________________
②1.00 L 1.00 mol·L-1H2SO4溶液与2.00 L 1.00 mol·L-1 NaOH溶液完全反
应,放出114.6 kJ热量,表示其中和热的热化学方程式为
_________________________________________________________________。
中和热的测定实验的关键是要比较准确地配制一定的物质的量浓度的溶液,在实验过程中要尽量避免热量的散失,要求比较准确地测量出反应前后溶液温度的变化。回答下列问题:
(1)从实验装置上看,图中尚缺少的一种玻璃用品是 。
(2)在大小烧杯之间填满碎泡沫(或纸条)其作用是____________________;大烧杯上如不盖硬纸板,求得的中和热数值 (填“偏大、偏小、无影响”)
(3)做一次完整的中和热实验,温度计需要使用______ 次;
(4)该实验常用0.50 mol·L-1 HCl和0.55 mol·L-1的NaOH溶液各50 mL。若上述HCl、NaOH溶液的密度都近似为1 g/cm3,中和后生成的溶液的比热容C =" 4.18" J/(g·℃),反应后温度升高了△t, 则生成1mol水时的反应热ΔH="___________" kJ/mol(填表达式)。
(5)如果用50mL0.50mol/L醋酸与50mL0.55mol/LNaOH溶液进行反应,与上述实验相比,所放出的热量 (填“相等、不相等”),简述理由 。
下图为某同学设计的一个原电池。
若电解质溶液为H2SO4:
①Fe是______极,其电极反应为_________________,该反应是__________(填“氧化”或“还原”)反应;
②Cu是______极,其电极反应为___________________,该电极上反应现象是________________;
若电解质溶液为CuSO4:
③Cu电极上电极反应为________________,其反应现象是________________。
2SO2(g)+O2(g)=2SO3(g)反应过程的能量变化如图所示。已知1mol SO2(g)氧化为1mol SO3的ΔH=—99kJ·mol-1.请回答下列问题:
(1)图中A、C分别表示___________、___________;
(2)图中△H= ___________KJ·mol-1;
(3)已知单质硫的燃烧热为296 KJ·mol-1,写出表示硫燃烧的热化学方程式 ___________;
(4)计算由S(s)生成3 molSO3(g)的△H = ___________ 。
有A、B、C、D、E、F六种短周期元素,它们的核电荷数按C、F、A、B、D、E的顺序增大。已知E、F位于同一主族;C、D都能分别与A按原子个数比为1∶1 或2∶1形成化合物;CB是一种10e- 的气态分子;E的M层电子数是K层电子数的2倍。
(1)写出下列元素的名称:B ,E ,F ;
(2)写出E在元素周期表中的位置第 周期第 族;
(3)写出D2A2的电子式 ;EB4
(4)用电子式表示FA2的形成过程 ;
(5)比较元素E和F的非金属性强弱,E的非金属性 于F(填“强”或“弱”),并用化学方程式证明上述结论 ;
(6)以上A、B、C、D中某些元素可形成的既含离子键又含非极性共价键的化合物是 ;既含离子键又含极性共价键的化合物是 。(写化学式)


 粤公网安备 44130202000953号
粤公网安备 44130202000953号