2012届河南省中考仿真模拟试卷
2011年6月中海油与美国康菲公司合作的渤海油田发生漏油事故,致使渔民损失惨重,沿海岸滩养殖的扇贝、海参、鱼虾大量死亡。仅马头营镇的海参养殖场,就遭受了一亿多元的经济损失。则下列说法不正确的是( )
| A.为杜绝环境污染,人类应停止一切石油开采 | B.此事件已对环境造成严重污染 |
| C.石油是一种由多种物质组成的混合物 | D.煤和石油都是化石燃料 |
地沟油对胃、肠、肝、心血管都会有损害,长期食用可能会引发癌症,一般通过看、闻、尝、听、问五个方面即可鉴别。下列鉴别方法中,一定涉及化学变化的是( )
| A.看:是否透明 | B.闻:是否有异味 |
| C.问:商家的进货渠道 | D.取油燃烧,听:是否发出噼啪响声 |
化学“家庭小实验”是利用家庭日常生活用品进行化学学习和探究的活动,根据你的经验,你认为下列家庭小实验不能成功的是 ( )
| A.检验纯碱中含有CO32- | B.用冷碟子放在蜡烛火焰上方制取炭黑 |
| C.用食醋除去热水瓶胆内的水垢 | D.用食盐水除去菜刀表面的铁锈 |
吸烟有害健康,是导致肺癌最广泛及作用最强的因素。非吸烟者往往会因吸烟者吸烟而造成被动吸烟,被动吸入的有害物质浓度并不比吸烟者低,今年开始我省已经禁止在公共场所吸烟,造成被动吸烟的原因是 ( )
| A.在化学变化中分子可以再分 | B.分子的大小不随温度改变而改变 |
| C.分子的体积很小,非吸烟者不易觉察 | D.分子在不断运动 |
逻辑推理是化学学习常用的思维方法。下列观点正确的是( )
| A.在同一化合物中,金属元素显正价,所以非金属元素一定显负价 |
| B.酸的溶液pH值小于7,碱的溶液pH大于7,所以盐的溶液pH值等于7 |
| C.氧化物只含有两种元素,所以氧化物中一定有一种元素不是氧元素 |
| D.酸碱中和反应生成盐和水,所以生成盐和水的反应一定是中和反应 |
下表列出了除去物质中所含少量杂质的方法,其中正确的是
来源:z.zs.tep.com]
| |
物 质 |
所含杂质 |
除去杂质的方法 |
| A |
NaOH溶液 |
Na2CO3 |
加入足量稀盐酸至不再产生气泡 |
| B |
CO气体 |
CO2 |
通过足量氢氧化钠溶液,并干燥 |
| C |
Fe粉 |
Cu粉 |
加入足量稀硫酸,充分反应,过滤并干燥 |
| D |
CaO固体 |
CaCO3 |
加水溶解,过滤 |
若已知X、Y、Z、W四种金属与化合物之间存在化学反应有:① Y + ZCl2 ="=" Z + YCl2、
② X + ZCl2="=Z" + XCl2、③ Y + 2HCl==YCl2 + H2↑、④W + YCl2== W Cl2 + Y;又知X与稀盐酸不能发生反应。试推断X、Y、Z三种 金属的活动性由强到弱的顺序是
金属的活动性由强到弱的顺序是
| A.Z>W>Y>X | B.X>Y>W>Z | C.W>Y>X>Z | D.Y>Z>X>W |
猕猴桃是河南著名土特产之一,肉肥汁多,清香鲜美,甜酸宜人,含有丰富的维生素C(化学式为C6H8O6),可强化免疫系统,促进伤口愈合和对铁质的吸收;它所富含的肌醇[化学式为(CHOH)6]及氨基酸,可抑制抑郁症,补充脑力所消耗的营养。下列有关说法正确的是 ( )
| A.肌醇由四种元素组成 |
| B.维生素C相对分子质量为176g |
| C.维生素C是由6个碳原子、8个氢原子和6个氧原子构成 |
| D.维生素C完全燃烧生成二氧化碳和水 |
若用○、 、 、表示不同的原子,这些相同或不相同的原子的组合可以构成不同分子,当用图示表示某个化学反应时,下列说法中,正确的是 ( )


| A.该反应前后所有元素的化合价都没有变化 |
| B.此反应是置换反应 |
| C.参加反应的两种分子的个数比为1:1 |
| D.该图示表示的化学反应符合质量守恒定律 |
将一定量的丙醇(C3H8O)和氧气置于一个封闭的容器中引燃,生成二氧化碳、水蒸气和一种未知物质W。现测得反应前后各物质的质量如下:
| 物质 |
丙醇 |
氧气 |
水 |
二氧化碳 |
W |
| 反应前质量/g |
6.0 |
12.8 |
0 |
0 |
0 |
| 反应后质量/g |
0 |
0 |
7.2 |
8.8 |
X |
下列有关说法错误的是:
A.W物质一定含有氢元素 B.该反应属于氧化反应
C.W物质一定含有氧元素 D.表中X的值为2.8
现有Ca、Na、H、C、O、S等六种元素,请选用其中一种或几种元素写出符合下列要求的化学式或化学方程式:
(1)治疗胃酸过多症的主要成分 。(2)造成空气污染的主要气体之一 。
(3)能于改良酸性土壤并可用于配置农药波尔多液的物质 ;
(4)有水生成的复分解反应 。
洛阳燕菜又称牡丹燕菜,为洛阳水席之头菜,制作十分精细,主料有白萝卜、海参、鱿鱼、鸡肉。“牡丹燕菜”中富含中营养素有: (写出一种即可)。
在生产生活中,你会发现“化学就在身边”。
(1)洗洁精能清除油污,这是利用它的 作用。
(2)在农业生产中,施用的草木灰(有效成份为K2CO3)属于 肥。
(3)在举重比赛时,运动员常用白色的“镁粉”搓手,这是因为“镁粉”质轻、吸水性好,可做防滑剂。“镁粉”的有效成份是碱式碳酸镁,它不可燃,300℃即分解,其分解的化学方程式是:Mg5(OH)2(CO3)4△ 5MgO+X+4CO2↑,则X的化学式是_____ 。
数字在化学式不同部位可表示不同的意义:①表示微粒的数目 ②表示元素的化合价 ③表示离子的电荷数
请你判断下列化学式中的“2”分别表示上述哪种含义?(填序号)
SO4 2- 2NO3- CaCO3
2- 2NO3- CaCO3
20℃时,分别向盛有10g水的的两支试管中,加入等质量的甲、乙两种固体物质,使其充分溶解,可观察到如右图所示的现象。
(1)20℃时, (填“A”或“B”)试管中的溶液一定是饱和溶液;
(2)右图2中表示甲物质的溶解度曲线的是
(填“a”或“b”),要使A试管中剩余的固体继续溶解可采用的方法是 。
锂元素(元素符号为Li)及其所形成的化合物,在通讯和航空航天领域中具有极其重要的用途。它的化合物氢氧化锂(LiOH)是一种易溶于水的白色固体,有辣味,具有强碱性和腐蚀性。
(1)写出氢氧化锂的一条物理性质________________________________;
(2)右表是部分物质的溶解性表,运用此溶解性表并结合你对复分解反应发生条件的理解,从表中选出一种盐,该盐能和LiOH发生复分解反应,请你写出该盐的化学式:_____________________________________________。
| |
OH- |
CO32- |
SO42- |
NO3- |
| Ba2+ |
溶 |
不 |
不 |
溶 |
| Cu2+ |
不 |
不 |
溶 |
溶 |
| Li+ |
溶 |
微溶 |
溶 |
溶 |
食品腌制中会产生亚硝酸盐,因亚硝酸盐易诱发癌症而严重影响人们的健康,有人设想:先向含有亚硝酸盐(NaNO2为例说明)的腌制食品中加入过量的氯化铵,共热后生成无毒、无害的氨气、水、和氯化钠;然后再持续加热,使过量的氯化铵分解为氨气、氯化氢气体,经过这样处理的腌制食品就可放心食用。请写出设想中两个反应的化学方程式:
⑴_______________________________;
⑵_______________________________。
右图是某微型实验的装置图。试管中反应发生后,(1)你可能观察到的现象有: 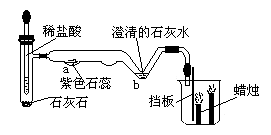
。
(2)微型实验装置的优点是(请答两点):
① ;② 。
A、B、C、D为初中常见的物质,相互之间的关系如图所示(“—”表示两种物质间能发生反应,“→”表示两种物质间能够转化,部分反应物或生成物以及反应条件已略去)。A是一种气体单质,D是温室气体。
① A的化学式是 ; ② B D的化学方程式是 。
② B D的化学方程式是 。
有一混合溶液是由硝酸、碳酸钠、硫酸、氯化铜四种物质中的两种混合而成,向该混合溶液中滴入Ba(OH)2溶液,产生沉淀的质量与加入 Ba(OH)2溶液体积的关系如图所示,据此回答:
(1)该混合溶液是由________和____ ___组成的。
(2)不含另外两种物质的理由:
一是________________________
二是_________________________________
不少同学都被蚊虫叮咬过,感觉又痛又痒。从化学课上得知:蚊虫叮咬时能在皮肤内分泌出蚁酸刺激皮肤。查阅资料:蚁酸是一种有机酸,化学名称叫做甲酸,化学式为HCOOH,通常是一种无色易挥发的液体,它在浓硫酸存在时加热发生如下反应:HCOOH浓硫酸CO↑+H2O。某化学兴趣小组同学决定使用下图仪器或装置利用甲酸制取CO,并进行CO还原Fe2O3(Fe2O3样品中杂质不参加反应)的探究实验。[来自:中国学考
请回答下列问题:
(1)用甲酸滴入浓硫酸的方法制取CO,应选用的发生装置是 (填代号,下同);要除去CO中含有的少量甲酸蒸汽,最好选用上图中的 进行洗气;检验CO还原Fe2O3的气体产物应选用 装置,需检验的气体应从 管口进入。
(2)写出CO还原Fe2O3的化学方程式______________________________。
(3)从开始加热到实验结束,Fe2O3粉末的颜色是如何变化的?_________________。
(4)CO有毒,从环保角度看,如何处理该实验的尾气?_________________。
(5)【拓展延伸】①当你被蚊虫叮咬后,在叮咬处涂抹一些物质可减轻痛痒。下列物质中,你不会选择的物质是________。
| A.氨水 | B.食醋 | C.肥皂水 | D.苏打水 |
②向某溶液中加入蚁酸有气泡产生,该气体能使澄清石灰水变浑浊,则该溶液中溶质的化学式可能是______________________________(只写一种)。
(6)利用以上装置可以测定Fe2O3样品中Fe2O3的质量分数。测定方法是:取10.0g Fe2O3样品做实验,先称量样品和玻璃管的总质量为60.0g,待样品完全反应并冷却后,在称量玻璃管和剩余固体的总质量为57.6g。求该样品中Fe2O3的质量分数是多少?
 粤公网安备 44130202000953号
粤公网安备 44130202000953号