2020年全国统一高考化学试卷(江苏卷)
反应8NH3+3Cl2═6NH4Cl+N2可用于氯气管道的检漏。下列表示相关微粒的化学用语正确的是( )
A.中子数为9的氮原子: N
B.N2分子的电子式:
C.Cl2分子的结构式:Cl﹣Cl
D.Cl﹣的结构示意图:
下列有关物质的性质与用途具有对应关系的是( )
A.铝的金属活泼性强,可用于制作铝金属制品
B.氧化铝熔点高,可用作电解冶炼铝的原料
C.氢氧化铝受热分解,可用于中和过多的胃酸
D.明矾溶于水并水解形成胶体,可用于净水
常温下,下列各组离子在指定溶液中能大量共存的是( )
A.0.1mol•L﹣1氨水溶液:Na+、K+、OH﹣、NO3﹣
B.0.1mol•L﹣1盐酸溶液:Na+、K+、SO42﹣、SiO32﹣
C.0.1mol•L﹣1KMnO4溶液:NH4+、Na+、NO3﹣、I﹣
D.0.1mol•L﹣1AgNO3溶液:NH4+、Mg2+、Cl﹣、SO42﹣
实验室以CaCO3为原料,制备CO2并获得CaCl2•6H2O晶体。下列图示装置和原理不能达到实验目的的是( )
A. 制备CO2B.
制备CO2B.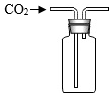 收集CO2
收集CO2
C.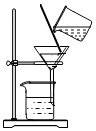 滤去CaCO3D.
滤去CaCO3D.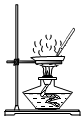 制得CaCl2•6H2O
制得CaCl2•6H2O
下列有关化学反应的叙述正确的是( )
A.室温下,Na在空气中反应生成Na2O2
B.室温下,Al与4.0mol•L﹣1NaOH溶液反应生成NaAlO2
C.室温下,Cu与浓HNO3反应放出NO气体
D.室温下,Fe与浓H2SO4反应生成FeSO4
下列指定反应的离子方程式正确的是( )
A.Cl2通入水中制氯水:Cl2+H2O⇌2H++Cl﹣+ClO﹣
B.NO2通入水中制硝酸:2NO2+H2O═2H++NO3﹣+NO
C.0.1mol•L﹣1NaAlO2溶液中通入过量CO2:AlO2﹣+CO2+2H2O═Al(OH)3↓+HCO3﹣
D.0.1mol•L﹣1AgNO3溶液中加入过量浓氨水:Ag++NH3+H2O═AgOH↓+NH4+
反应SiCl4(g)+2H2(g) Si(s)+4HCl(g)可用于纯硅的制备。下列有关该反应的说法正确的是( )
A.该反应△H>0、△S<0
B.该反应的平衡常数K
C.高温下反应每生成1mol Si需消耗2×22.4L H2
D.用E表示键能,该反应△H=4E(Si﹣Cl)+2E(H﹣H)﹣4E(H﹣Cl)
下列关于Na、Mg、Cl、Br元素及其化合物的说法正确的是( )
A.NaOH的碱性比Mg(OH)2的强
B.Cl2得到电子的能力比Br2的弱
C.原子半径r:r(Br)>r(Cl)>r(Mg)>r(Na)
D.原子的最外层电子数n:n(Na)<n(Mg)<n(Cl)<n(Br)
下列选项所示的物质间转化均能实现的是( )
A.NaCl(aq) Cl2(g) 漂白粉(s)
B.NaCl(aq) NaHCO3(s) Na2CO3(s)
C.NaBr(aq) Br2(aq) I2(aq)
D.Mg(OH)2(s) MgCl2(aq) Mg(s)
将金属M连接在钢铁设施表面,可减缓水体中钢铁设施的腐蚀。在如图所示的情境中,下列有关说法正确的是( )
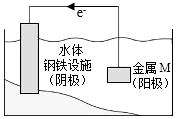
A.阴极的电极反应式为Fe﹣2e﹣═Fe2+
B.金属M的活动性比Fe的活动性弱
C.钢铁设施表面因积累大量电子而被保护
D.钢铁设施在河水中的腐蚀速率比在海水中的快
化合物Z是合成某种抗结核候选药物的重要中间体,可由下列反应制得。
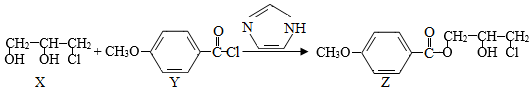
下列有关化合物X、Y和Z的说法正确的是( )
A.X分子中不含手性碳原子
B.Y分子中的碳原子一定处于同一平面
C.Z在浓硫酸催化下加热可发生消去反应
D.X、Z分别在过量NaOH溶液中加热,均能生成丙三醇
根据下列实验操作和现象所得到的结论正确的是( )
选项 |
实验操作和现象 |
结论 |
A |
向淀粉溶液中加适量20% H2SO4溶液,加热,冷却后加NaOH溶液至中性,再滴加少量碘水,溶液变蓝 |
淀粉未水解 |
B |
室温下,向0.1mol•L﹣1HCl溶液中加入少量镁粉,产生大量气泡,测得溶液温度上升 |
镁与盐酸反应放热 |
C |
室温下,向浓度均为0.1mol•L﹣1的BaCl2和CaCl2混合溶液中加入Na2CO3溶液,出现白色沉淀 |
白色沉淀是BaCO3 |
D |
向0.1mol•L﹣1H2O2溶液中滴加0.01mol•L﹣1KMnO4溶液,溶液褪色 |
H2O2具有氧化性 |
A.AB.BC.CD.D
室温下,将两种浓度均为0.10mol•L﹣1的溶液等体积混合,若溶液混合引起的体积变化可忽略,下列各混合溶液中微粒物质的量浓度关系正确的是( )
A.NaHCO3﹣Na2CO3混合溶液(pH=10.30):c(Na+)>c(HCO3﹣)>c(CO32﹣)>c(OH﹣)
B.氨水﹣NH4Cl混合溶液(pH=9.25):c(NH4+)+c(H+)=c(NH3•H2O)+c(OH﹣)
C.CH3COOH﹣CH3COONa混合溶液(pH=4.76):c(Na+)>c(CH3COOH)>c(CH3COO﹣)>c(H+)
D.H2C2O4﹣NaHC2O4混合溶液(pH=1.68,H2C2O4为二元弱酸):c(H+)+c(H2C2O4)═c(Na+)+c(C2O42﹣)+c(OH﹣)
CH4与CO2重整生成H2和CO的过程中主要发生下列反应
CH4(g)+CO2(g)═2H2(g)+2CO(g)△H=247.1kJ•mol﹣1
H2(g)+CO2(g)═H2O(g)+CO(g)△H=41.2kJ•mol﹣1
在恒压、反应物起始物质的量比n(CH4):n(CO2)=1:1 条件下,CH4和CO2的平衡转化率随温度变化的曲线如图所示。下列有关说法正确的是( )

A.升高温度、增大压强均有利于提高CH4的平衡转化率
B.曲线B表示CH4的平衡转化率随温度的变化
C.相同条件下,改用高效催化剂能使曲线A和曲线B相重叠
D.恒压、800K、n(CH4):n(CO2)=1:1 条件下,反应至CH4转化率达到X点的值,改变除温度外的特定条件继续反应,CH4转化率能达到Y点的值
吸收工厂烟气中的SO2,能有效减少SO2对空气的污染。氨水、ZnO水悬浊液吸收烟气中SO2后经O2催化氧化,可得到硫酸盐。
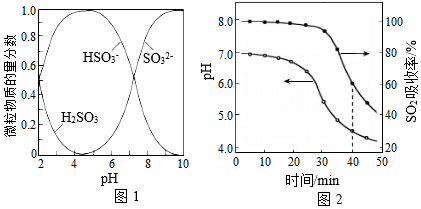
已知:室温下,ZnSO3微溶于水,Zn(HSO3)2易溶于水;溶液中H2SO3、HSO3﹣、SO32﹣的物质的量分数随pH的分布如图1所示。
(1)氨水吸收SO2.向氨水中通入少量SO2,主要反应的离子方程式为 ;当通入SO2至溶液pH=6时,溶液中浓度最大的阴离子是 (填化学式)。
(2)ZnO水悬浊液吸收SO2.向ZnO水悬浊液中匀速缓慢通入SO2,在开始吸收的40min内,SO2吸收率、溶液pH均经历了从几乎不变到迅速降低的变化(如图2)。溶液pH几乎不变阶段,主要产物是 ( 填化学式);SO2吸收率迅速降低阶段,主要反应的离子方程式为 。
(3)O2催化氧化。其他条件相同时,调节吸收SO2得到溶液的pH在4.5~6.5范围内,pH越低SO42﹣生成速率越大,其主要原因是 ;随着氧化的进行,溶液的pH将 (填“增大”、“减小”或“不变“)。
)化合物F是合成某种抗肿瘤药物的重要中间体,其合成路线如图:
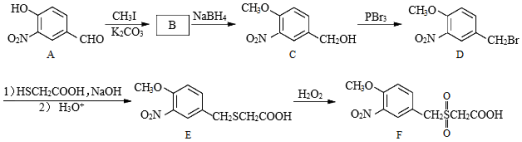
(1)A中的含氧官能团名称为硝基、 和 。
(2)B的结构简式为 。
(3)C→D的反应类型为 。
(4)C的一种同分异构体同时满足下列条件,写出该同分异构体的结构简式 。
①能与FeCl3溶液发生显色反应。
②能发生水解反应,水解产物之一是α﹣氨基酸,另一产物分子中不同化学环境的氢原子数目比为1:1且含苯环。
(5)写出以CH3CH2CHO和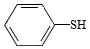 为原料制备
为原料制备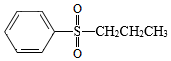 的合成路线流程图(无机试剂和有机溶剂任用,合成路线流程图示例见本题题干)。
的合成路线流程图(无机试剂和有机溶剂任用,合成路线流程图示例见本题题干)。
次氯酸钠溶液和二氯异氰尿酸钠(C3N3O3Cl2Na)都是常用的杀菌消毒剂。NaClO可用于制备二氯异氰尿酸钠。
(1)NaClO溶液可由低温下将Cl2缓慢通入NaOH溶液中而制得。制备NaClO的离子方程式为 ;用于环境杀菌消毒的NaClO溶液须稀释并及时使用,若在空气中暴露时间过长且见光,将会导致消毒作用减弱,其原因是 。
(2)二氯异氰尿酸钠优质品要求有效氯大于60%.通过下列实验检测二氯异氰尿酸钠样品是否达到优质品标准。实验检测原理为
C3N3O3Cl2﹣+H++2H2O═C3H3N3O3+2HClO
HClO+2I﹣+H+═I2+Cl﹣+H2O I2+2S2O32﹣═S4O62﹣+2I﹣
准确称取1.1200g样品,用容量瓶配成250.0mL溶液:取25.00mL上述溶液于碘量瓶中,加入适量稀硫酸和过量KI溶液,密封在暗处静置5min;用0.1000mol•L﹣1Na2S2O3标准溶液滴定至溶液呈微黄色,加入淀粉指示剂,继续滴定至终点,消耗Na2S2O3溶液20.00mL。
①通过计算判断该样品是否为优质品。
(写出计算过程,该样品的有效氯 100% )
②若在检测中加入稀硫酸的量过少,将导致样品的有效氯测定值 ( 填“偏高”或“偏低”)。
实验室由炼钢污泥(简称铁泥,主要成分为铁的氧化物)制备软磁性材料α﹣Fe2O3.其主要实验流程如图。

(1)酸浸。用一定浓度的H2SO4溶液浸取铁泥中的铁元素。若其他条件不变,实验中采取下列措施能提高铁元素浸出率的有 (填序号)。
A.适当升高酸浸温度
B.适当加快搅拌速度
C.适当缩短酸浸时间
(2)还原。向“酸浸”后的滤液中加入过量铁粉,使Fe3+完全转化为Fe2+.“还原”过程中除生成Fe2+外,还会生成 (填化学式);检验Fe3+是否还原完全的实验操作是 。
(3)除杂。向“还原”后的滤液中加入NH4F溶液,使Ca2+转化为CaF2沉淀除去。若溶液的pH偏低,将会导致CaF2沉淀不完全,其原因是 [Ksp(CaF2)=5.3×10﹣9,Ka(HF)=6.3×10﹣4]。
(4)沉铁。将提纯后的FeSO4溶液与氨水﹣NH4HCO3混合溶液反应。生成FeCO3沉淀。
①生成FeCO3沉淀的离子方程式为 。
②设计以FeSO4溶液、氨水﹣NH4HCO3混合溶液为原料,制备FeCO3的实验方案: [FeCO3沉淀需“洗涤完全”,Fe(OH)2开始沉淀的pH=6.5]。
CO2/HCOOH循环在氢能的贮存/释放、燃料电池等方面具有重要应用。
(1)CO2催化加氢。在密闭容器中,向含有催化剂的KHCO3溶液(CO2与KOH溶液反应制得)中通入H2生成HCOO﹣,其离子方程式为 ;其他条件不变,HCO3﹣转化为HCOO﹣的转化率随温度的变化如图1所示。反应温度在40℃~80℃范围内,HCO3﹣催化加氢的转化率迅速上升,其主要原因是 。

(2)HCOOH燃料电池。研究HCOOH燃料电池性能的装置如图2所示,两电极区间用允许K+、H+通过的半透膜隔开。
①电池负极电极反应式为 ;放电过程中需补充的物质A为 (填化学式)。
②如图2所示的HCOOH燃料电池放电的本质是通过HCOOH与O2的反应,将化学能转化为电能,其反应的离子方程式为 。
(3)HCOOH催化释氢。在催化剂作用下,HCOOH分解生成CO2和H2可能的反应机理如图3所示。
①HCOOD催化释氢反应除生成CO2外,还生成 (填化学式)。
②研究发现:其他条件不变时,以HCOOK溶液代替HCOOH催化释氢的效果更佳,其具体优点是 。
以铁、硫酸、柠檬酸、双氧水、氨水等为原料可制备柠檬酸铁铵[(NH4)3Fe(C6H5O7)2].
(1)Fe基态核外电子排布式为 ;[Fe(H2O)6]2+中与Fe2+配位的原子是 (填元素符号).
(2)NH3分子中氮原子的轨道杂化类型是 ;C、N、O元素的第一电离能由大到小的顺序为 .
(3)与NH4+互为等电子体的一种分子为 (填化学式).
(4)柠檬酸的结构简式如图.1mol柠檬酸分子中碳原子与氧原子形成的σ键的数目为 mol.

羟基乙酸钠易溶于热水,微溶于冷水,不溶于醇、醚等有机溶剂。制备少量羟基乙酸钠的反应为ClCH2COOH+2NaOH→HOCH2COONa+NaCl+H2O△H<0
实验步骤如下:
步骤1:在如图所示装置的反应瓶中,加入40g氯乙酸、50mL水,搅拌。逐步加入40% NaOH溶液,在95℃继续搅拌反应2小时,反应过程中控制pH约为9。
步骤2:蒸出部分水至液面有薄膜,加少量热水,趁热过滤。滤液冷却至15℃,过滤得粗产品。
步骤3:粗产品溶解于适量热水中,加活性炭脱色,分离掉活性炭。
步骤4:将去除活性炭后的溶液加到适量乙醇中,冷却至15℃以下,结晶、过滤、干燥,得羟基乙酸钠。
(1)步骤1中,如图所示的装置中仪器A的名称是 ;逐步加入NaOH溶液的目的是 。
(2)步骤2中,蒸馏烧瓶中加入沸石或碎瓷片的目的是 。
(3)步骤3中,粗产品溶解于过量水会导致产率 ( 填“增大”或“减小”);去除活性炭的操作名称是 。
(4)步骤4中,将去除活性炭后的溶液加到适量乙醇中的目的是 。

 粤公网安备 44130202000953号
粤公网安备 44130202000953号