2019年江苏省镇江市中考化学试卷
下列物质的用途主要与其化学性质有关的是( )
A.金刚石用于切割玻璃B.高粱常用于酿制白酒
C.铜常用来做电线电缆D.干冰可用作人工降雨
下列化学用语正确的是( )
A.二个氮分子﹣﹣﹣﹣2NB.氦气﹣﹣﹣﹣He2
C.二硫化碳﹣﹣﹣CS2D.锌离子﹣﹣﹣Zn+2
下列归类正确的是( )
选项 |
归类 |
内容 |
A |
常见的碱 |
纯碱、氨水、火碱 |
B |
挥发性酸 |
浓盐酸、浓硫酸、浓硝酸 |
C |
大气污染物 |
PM2.5、二氧化硫、二氧化碳 |
D |
有机高分子材料 |
聚乙烯、聚氯乙烯、有机玻璃 |
A.AB.BC.CD.D
下列实验方法正确的是( )
A.用50mL量筒量取5.0mL的水
B.用水电解实验说明水由氢、氧元素组成
C.用活性炭使硬水转化为软水
D.观察颜色区分黄金和黄铜(铜锌合金)
下列对实验现象的描述或实验操作正确的是( )
A.镁条在空气中燃烧,产生大量白雾
B.高锰酸钾制取氧气后,试管趁热清洗
C.碘化钾溶液和硝酸银溶液混合,生成黑色沉淀
D.粗盐提纯实验中,待滤悬浊液静置后过滤
如图是甲转化为丁的微观过程。下列说法正确的是( )
A.转化①中原子种类不变,个数改变
B.转化②是化合反应
C.整个过程中共有2种氧化物
D.物质丁是复合肥
下列指定反应的化学方程式正确的是( )
A.酸雨形成的原因CO2+H2O═H2CO3
B.证明铜的活动性大于银:Cu+2AgCl═2Ag+CuCl2
C.用含氢氧化铝的药物治疗胃酸过多:Al(OH)3+3HCl═AlCl3+3H2O
D.超氧化钾(KO2)与二氧化碳反应生成碳酸钾和氧气:2KO2+CO2═K2CO3+O2
电解饱和氯化钠溶液的化学方程式:2NaCl+2H2O 2NaOH+H2↑+Cl2↑下列说法中不正确的是( )
A.Cl2可用于自来水生产中杀菌消毒
B.农业上常用NaOH改良酸性土壤
C.反应中有2种元素化合价发生改变
D.NaCl可由海水蒸发结晶、精制获得
下列物质的转化在给定条件下均能实现的是( )
A.NaHCO3 Na2CO3 NaOH
B.KMnO4 O2 Cu2(OH)2CO3
C.Na2CO3 Na2SO4 NaCl
D.K2SO4 BaSO4 Ba(NO3)2
下列实验操作能达到实验目的是( )
选项 |
物质 |
目的 |
主要实验操作 |
A |
CO2和N2 |
鉴别 |
分别用燃着的木条试验,观察现象 |
B |
CaCl2溶液中混有少量盐酸 |
检验 |
取样,滴加AgNO3溶液,观察是否产生沉淀 |
C |
Na2SO4溶液中混有少量MgSO4 |
除杂 |
加入Ba(OH)2溶液至不再产生沉淀,过滤 |
D |
KCl和BaCl2的混合溶液 |
分离 |
加入过量的K2CO3溶液,过滤、洗涤,再分别向滤渣和滤液中加入适量稀盐酸 |
A.AB.BC.CD.D
向200.0g AgNO3溶液中加入m克Fe和Cu的混合粉末,搅拌,充分反应后过滤、洗涤、干燥得32.4g固体。向滤液中滴加NaCl溶液,产生白色沉淀。下列说法正确的是( )
A.滤液的质量是167.6g
B.混合粉末的质量范围是8.4<m<9.6
C.固体中加入稀盐酸可能会有气体生成
D.原AgNO3溶液的溶质质量分数是25.5%
下列说法正确的是( )
A.金刚石、石墨、C60都是碳单质
B.铝的金属活动性比铁强,所以铁比铝更加耐腐蚀
C.某气体不能使带火星木条复燃,该气体中一定不含氧气
D.使饱和溶液析出晶体,溶质质量和溶质质量分数都一定减小
T1℃时,将等质量的KNO3、KCl分别加入到各盛有100.0g水的两个烧杯中,充分搅拌后恢复到T1℃,现象如图1、2所示。下列说法正确的是( )

A.甲中加入的固体是KNO3
B.甲中溶液可能是该溶质的饱和溶液,乙中上层清液一定是该溶质的饱和溶液
C.将甲、乙中的物质混合,充分搅拌,一定有固体剩余
D.若将甲、乙的温度从T1℃升高到T2℃,两溶液中的溶质质量分数相等
有Fe2(SO4)3和H2SO4的混合溶液200.0g,先向其中滴加BaCl2溶液,再滴加8.0%的NaOH溶液,产生沉淀质量与滴加溶液质量关系如图所示。下列说法正确的是( )
A.a点溶液呈中性
B.b~c段只发生了1个反应
C.c点对应的沉淀有2种,m=500
D.原混合溶液中铁、硫元素质量比是7:10
下列各组溶液,不用其他试剂就能鉴别出来的是( )
A.FeCl3、NaOH、KCl、Ba(NO3)2
B.K2CO3、Ba(OH)2、KOH、稀HNO3
C.K2SO4、Na2CO3、稀HCl、稀HNO3
D.CaCl2、AgNO3、Mg(NO3)2、NaCl
已知CaSO4+(NH4)2CO3=CaCO3↓+(NH4)2SO4.如图为模拟烟气处理并得到轻质CaCO3的主要流程。下列说法正确的是( )
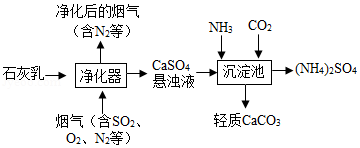
A.净化时用石灰乳而不用石灰水,是为了充分吸收SO2
B.净化时反应的化学方程式:Ca(OH)2+SO2+O2=CaSO4+H2O
C.沉淀时应先通入CO2后,再通入NH3,有利于CaCO3的生成
D.由沉淀池中发生的反应可知,溶解性:CaSO4>CaCO3
用化学符号表示:
(1)水银 。
(2)2个钠离子 。
(3)人体缺少 元素会导致甲状腺疾病。
(4)最常用的溶剂 。
选择下列适当的物质填空(选填序号):
A.明矾 B.硝酸 C.洗洁精 D.熟石灰 E.硫酸 F.食盐 G.维生素 H.硝酸铵
(1)溶于水温度降低的是 。
(2)生活中作乳化剂的是 。
(3)铅蓄电池含有的酸是 。
(4)厨房中作调味品的是 。
(5)可配制波尔多液的是 。
(6)蔬菜,水果中富含有 。
合金是重要的金属材料。
(1)Mg,Al按其一定比例熔合后冷却可得到储氢合金材料。该过程属于 变化(选填“物理”或“化学”)
(2)图中能表示锡铅合金的是 (选填“a”“b”或“c”)

用废铜屑生产硫酸铜晶体(CuSO4•5H2O)的流程如下: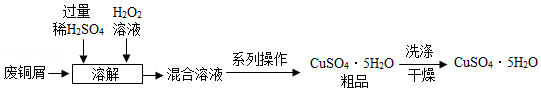
(1)“溶解”时需要加热,但温度不宜过高,原因是 。
(2)“系列操作”包括:除杂、蒸发浓缩、 、过滤等。过滤时用到的玻璃仪器有烧杯,漏斗、 。
(3)“洗涤”时为减少晶体损失,最好选用 (选填序号)。
a.热水 b.冰水 c.95%的酒精溶液
根据如图实验,回答问题:
(1)FeSO4中硫元素的化合价为 。
(2)生成红褐色固体的总反应的化学方程式为 。
提示:①Fe(OH)2在空气中极易被氧化。②方程式中FeSO4的配平系数为4。

请结合如图回答问题:

(1)仪器名称:① ,② 。
(2)实验室用氯酸钾和二氧化锰制取并收集O2,可选用发生装置 (选填序号)和收集装置D组合,反应的化学方程式为 。
(3)实验室制取CO2的化学方程式为 ,用装置C相对于B的优点是 ,CO2可用装置E收集,理由是 。
(4)实验室用FeS和稀H2SO4反应制取H2S.H2S是有毒气体,能溶于水,其水溶液为氢硫酸。

①制取H2S的化学方程式为 。
②图中“防倒吸装置”应选择 (选填“甲”或“乙”)
③NaOH溶液的作用是 。
草酸(H2C2O4)是一种酸,易溶于水。
(一)草酸的化学性质
(1)草酸溶液的pH 7(选填“>”“<”或“=”)。
(2)草酸溶液中加入石灰水,生成草酸钙(CaC2O4)固体,该反应的化学方程式为 。
(二)CaC2O4热分解探究
资料:CaC2O4 CaCO3+CO↑
兴趣小组称一定量的CaC2O4固体,在老师的指导下用如图装置进行实验。

实验一:先通入N2,再加热相应固体,一段时间后停止加热,缓缓通入N2至试管冷却。
(1)装置B增重6.6g,装置B中发生反应的化学方程式为 。
(2)装置C中观察到 的现象,说明反应生成CO。
实验二:取出实验一后装置A试管中的剩余固体,按图①﹣③进行实验。
(3)②中温度升高,则剩余固体中含有 ,③中产生2.2g气体。
(4)将③中溶液蒸发得CaCl2固体22.2g。
结论:(1)取用的CaC2O4固体的质量为 g。
(2)本实验中CaC2O4分解的总反应化学方程式为 。
现有一包固体粉末,可能含有K2SO4,CuSO4,NaOH,BaCl2,Mg(NO3)2,BaCO3中的一种或几种。进行如下实验:
(1)取少量固体溶于足量水中,过滤得到白色固体A和无色滤液B,则原固体中一定不含有 。
(2)向固体A中加入足量稀盐酸,固体全部溶解,无气泡产生,则原固体中一定含有 一定不含有 。
(3)向滤液B中通入CO2,产生白色沉淀,则原固体中一定还含有 ,一定不含有 。
如图为某些物质间的转化关系(部分反应条件省略)。A、B、E、F、G均为气体,B能使稀高锰酸钾溶液褪色,E、F组成元素相同,且F有毒,G是一种最轻的气体;乙、丁均为黑色的固体氧化物,反应④是工业炼铁的原理;反应②是光合作用。

(1)化学式:G ,丙 。
(2)反应①、④的化学方程式:① ;④ 。
(3)甲一定含有的元素是 。
(4)Fe与蓝色溶液的反应属于 反应(填基本反应类型)。
金属及其化合物在生产生活中有广泛的应用。

(一)金属的应用和防护
(1)用不锈钢、合成橡胶、氧化镁等材料制造的飞机轮胎属于 材料。
(2)航空煤油是飞机的燃料,它主要是由 炼制的。
(3)铁易生锈,提出防止铁生锈的一种方法 。
(4)特种钢中含有少量Mn、MnO2和Al粉混合在高温下反应可得到Mn,该反应的化学方程式为 。
(5)Mg(OH)2受热分解生成高熔点的MgO.Mg(OH)2可用作阻燃剂,其主要原理是 (选填序号)。
a.分解吸热,降低可燃物着火点 b.MgO覆盖燃烧物,隔绝氧气
(二)制备还原性铁粉
实验室利用废铁屑(含少量Fe2O3)为原料制备还原性铁粉的流程如下:
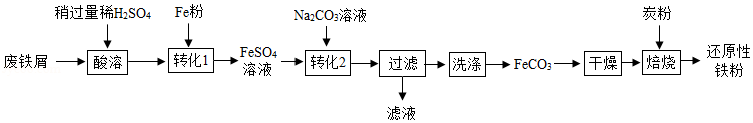
(1)Fe粉可使“酸溶”产生的Fe2(SO4)3转化为FeSO4,该反应的化学方程式为 。
(2)检验FeCO3已洗净的方法:取最后一次洗涤后的滤液,先加入一定量稀盐酸,再滴加 溶液,无明显现象。
(3)“干燥”时有少量FeCO3发生下列转化:FeCO3 FeOOH+CO2,该转化的化学方程式为 。
(4)“焙烧”前,应将炭粉与“干燥”所得固体均匀混合,目的是 。
(三)测定还原性铁粉的组成
还原性铁粉中含有少量FexCy,小组同学在老师的指导下进行以下实验。
资料:①Fe,FexCy在加热时与O2反应能生成相应氧化物。
②FexCy不与酸反应。
实验1:取29.52g样品,加入足量稀H2SO4,充分反应后生成1.00gH2。
实验2:另取29.52g样品,按如图进行实验。
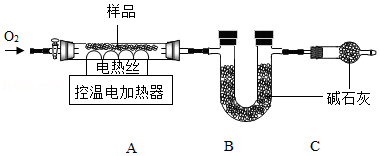
表:装置A和B的质量变化
装置 |
A |
B |
反应前 |
300.00 |
400.00 |
反应后 |
m |
400.44 |
实验后A中固体全部变为红棕色,装置A、B的质量变化如上表。
(1)装配好装置后,实验前先要 。
(2)装置C的作用是 。
(3)FexCy中,x:y= 。表中m的值是 。
反思:若用空气替代O2进行实验,测得x:y的值偏大,可能的原因是 。
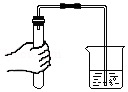 检查气密性B.
检查气密性B.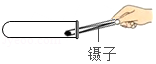 加入锌粒
加入锌粒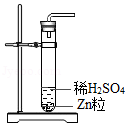 产生氢气D.
产生氢气D.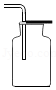 收集氢气
收集氢气 B.铜元素的质量分数:
B.铜元素的质量分数:
 D.金属单质的导电性:
D.金属单质的导电性:
 粤公网安备 44130202000953号
粤公网安备 44130202000953号