2019年福建省中考化学试卷
十一世纪,中国就用"卓筒井"凿井技术获取食盐。食盐的主要成分是( )
| A. |
NaHCO 3 |
B. |
Na 2CO 3 |
C. |
NaCl |
D. |
NaOH |
下列应用只涉及物质的物理性质的是( )
| A. |
煤用作燃料 |
| B. |
干冰用于人工降雨 |
| C. |
熟石灰用于改良酸性土壤 |
| D. |
生石灰用作干燥剂 |
《化学通讯》报道:"人造肉汉堡"的研制被称为突破性技术,可以减轻畜牧业生产造成的环境污染。"人造肉"的营养价值接近真实肉类,它可以为人体补充的最重要的营养素是( )
| A. |
蛋白质 |
B. |
糖类 |
C. |
维生素 |
D. |
无机盐 |
高氯酸钾(KClO 4)可用于制备火箭燃料。有关KClO 4的说法正确的是( )
| A. |
含6种元素 |
| B. |
属于混合物 |
| C. |
氯元素的化合价为+6 |
| D. |
钾、氧元素的质量比为39:64 |
化学与生产、生活息息相关,下列说法错误的是( )
| A. |
油锅着火,可用锅盖盖灭 |
| B. |
港珠澳大桥使用的吊绳所含的聚乙烯纤维,属于有机合成材料 |
| C. |
洗洁精有乳化作用,可用来清洗油污 |
| D. |
为延长食品的保质期,可用福尔马林(甲醛的水溶液)作防腐剂 |
一定条件下,水在密闭容器里的冷却过程中,温度和时间的关系如图所示。①、②、③表示水在不同时刻的存在状态,下列有关判断正确的是( )

| A. |
水分子间的间隔:①>③ |
| B. |
水分子的运动速率:②>① |
| C. |
状态③的水分子静止不动 |
| D. |
①→②发生了化学变化 |
下列实验操作不能达到实验目的是( )
实验目的 |
实验操作 |
|
A |
区别蚕丝与棉线 |
取样,灼烧,辨别气味 |
B |
鉴别H 2SO 4溶液和NaOH溶液 |
取样,滴加酚酞溶液,观察现象 |
C |
区别硬水和软水 |
取样,加肥皂水,振荡,观察现象 |
D |
配制100g溶质质量分数为20%的盐酸 |
将20g浓盐酸加入80g水中,充分搅拌 |
| A. |
A |
B. |
B |
C. |
C |
D. |
D |
KNO 3的溶解度曲线如图所示。下列说法错误的是( )
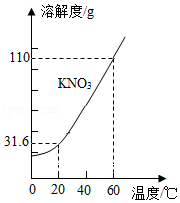
| A. |
0﹣60℃,KNO 3的溶解度随温度升高而增大 |
| B. |
60℃时的KNO 3饱和溶液降温至20℃,有晶体析出 |
| C. |
20℃时,100g水中最多能溶解31.6g KNO 3 |
| D. |
60℃时,可配制溶质质量分数为60%的KNO 3溶液 |
t℃时,加热烧杯中的石灰水,发现溶液变浑浊,测得此时溶液的pH>7.关于溶液变浑浊的原因,同学们有两种观点:①Ca(OH) 2的溶解度随温度升高而减小;②Ca(OH) 2与空气中的CO 2反应。他们设计以下方案进行探究,其中没有意义的是( )
| A. |
将装有浊液的烧杯,用冰水冷却,恢复至t℃,观察浑浊是否消失 |
| B. |
取适量浊液,过滤,往滤渣中加入盐酸,观察是否有气泡产生 |
| C. |
取适量浊液,过滤,往滤液中加入Na 2CO 3溶液,观察是否有沉淀生成 |
| D. |
其他条件不变,隔绝空气,再做一个加热石灰水的对比实验 |
2019年是"国际化学元素周期表年"。
(1)中国科学院院土张青莲对铟、铱、锗等的相对原子质量的测定做出了杰出贡献。锗元素在元素周期表中的部分信息如图所示,锗的相对原子质量为 ,该元素属于 (填"金属元素"或"非金属元素") 。
(2)中国科学家姜雪峰当选为"全球青年化学家元素周期表硫元素大使"。
①如图是硫原子结构示意图,硫原子的最外层电子数是 ;硫离子的符号为 ;硫离子与硫原子的化学性质 (填"相同"或"不同")。
②火药是中国古代四大发明之一。黑火药爆炸的反应为S+3C+2KNO 3 X+3CO 2↑+N 2↑,X的化学式是 。

塑料制品为人类带来了便利的同时,也造成了环境问题。科研人员为此提出多种解决方案。
(1)塑料的回收再利用意义重大。下列属于回收标志的是 (填标号)

(2)科学家用纤维素、甲壳素等材料研制出能完全降解的保鲜膜,这一发明有望缓解的环境问题是 (写一点)。
(3)回收的保鲜膜可转化为甲烷等燃料,甲烷完全燃烧的化学方程式为 。
(4)焚烧回收的保鲜膜,生成的CO 2可用来生产化工产品乙酸(CH 3COOH),转化的微观过程如图所示。
该反应过程中,保持不变的微粒是 (填"分子"或"原子"),反应物CO 2与产物CH 3COOH的分子个数比为 。

用如图所示装置模拟废液(含CuSO4、MgSO4及一些不溶物)净化实验、步骤如下:
Ⅰ往沉降槽中加入适量絮凝剂(混凝剂)甲,加速沉降;
Ⅱ往反应槽中缓慢加入一定浓度的NaOH溶液。至沉淀完全;
Ⅲ通过盛装有活性炭的水槽后。调节溶液的pH=7,存在指定容器中。
(1)测得原废液pH=5,显 (填“酸性”“碱性”或“中性”)。
(2)甲是 (写物质名称);操作X可使固体与液体分离,操作X是 ;活性炭的作用是 。
(3)反应槽中生成沉淀的化学方程式为 (写一个)。

《天工开物》中介绍了锌的冶炼方法:把炉甘石(ZnCO3)和煤炭饼装入炼锌罐(如图所示》,泥封,“其底铺薪,发火煅红”“冷定毁罐取出。”
(已知,锌的熔点为419℃,沸点为907℃)
(1)反应区中,ZnCO3分解生成ZnO和另一种氧化物,反应的化学方程式为 。C与ZnO发生置换反应得到Zn,反应中化合价升高的元素是 。
(2)冷凝区中,锌由气态转化为液态,理论上该区应控制的温度范围是 。
(3)“冷定”后方能“毁罐“取锌,从化学变化角度解释其原因: 。

如图所示,甲、乙、丙、丁、戊五种物质(或其溶液)俨然是滑冰赛道上参加接力比赛的“运动员”,相邻“运动员”之间能发生化学反应。已知:五种物质分别是Fe、HCl、NaOH、CaCO3和CuCl2中的一种,其中,甲是单质,丁与戊反应产生的气体可以熄灭终点的火炬。
(1)甲能分别与另四种物质中的 、 反应(写化学式)。
(2)丁与戊反应的化学方程式为 。
(3)丙与丁的反应属于 (填基本反应类型)。
(4)若把无机物按单质、氧化物、酸、碱和盐进行分类,无机物X的类别不同于上述五种物质,如果用X替换戊,它也能与丁反应生成一种生活中常用的液态灭火剂,X是 (写一种) 。

实验室制取氧气并模拟氢氧焰实验。
(1)用过氧化氢制取氧气(二氧化锰作催化剂)
①反应的化学方程式为 。
②仪器A的名称为 。现用下列仪器组装氧气的发生装置,应选用的仪器有 (填标号)。
③欲用浓硫酸干燥氧气,应从装置F的 (填“a”或“b”)处通入气体。

(2)模拟氢氧焰实验:
按图2所示装置进行实验。
①关闭K,通入氢气,点燃。为保证安全,点燃氢气之前应先 。将铁丝网放在火焰上灼烧,铁丝网只发红,不熔断。
②打开K,通入氧气,火焰更明亮,铁丝熔断,说明燃烧的剧烈程度与氧气的 有关。
某兴趣小组开展“测定密闭容器中某种气体的体积分数”的探究实验。
[实验1]按图1所示装置,用红磷燃烧的方法测定空气中氧气的体积分数。
[实验2]按图2所示装置,在集气瓶内壁用水均匀涂附铁粉除氧剂(其中辅助成分不干扰实验),利用铁锈蚀原理测定空气中氧气的体积分数。

(1)实验1中,红磷燃烧的主要现象是 。红磷熄灭后,集气瓶冷却至室温,打开K,水能倒吸入集气瓶的原因是 。
(2)为提高实验的准确性,以上两个实验都需要注意的事项是 (写一点)。
(3)实验过程中,连接数字传感器,测得实验1、实验2中氧气的体积分数随时间变化的关系分别如图3、图4所示。依据图3,图4信息, (填“实验1”或“实验2”)的测定方法更准确,判断依据是 。

(4)结合你的学习经验,若要寻找红磷或铁粉除氧剂的替代物,用图1或图2装置测定空气中氧气的体积分数,该替代物应满足的条件是 (写两点)。
[实验3]测定用排空气法收集到的集气瓶中二氧化碳的体积分数。

(5)甲同学设计图5所示装置进行测定。浓NaOH溶液的作用是 (用化学方程式表示)。
(6)乙同学提出,仅利用图6所示装置,在不添加其他试剂的前提下,也能测得集气瓶中二氧化碳的体积分数。为达到实验目的,操作方法是 。
 稀释浓硫酸
稀释浓硫酸 倾倒液体
倾倒液体 读取液体体积
读取液体体积 点燃酒精灯
点燃酒精灯 粤公网安备 44130202000953号
粤公网安备 44130202000953号