2017年江苏省淮安市中考化学试卷
下列做法会危害人体健康的是( )
A.饮用低温灭菌牛奶B.食用新鲜蔬菜水果
C.用小苏打做发酵粉D.用甲醛浸泡水产品
某博物馆藏有一柄古代铁剑,为防止其生锈,下列做法合理的是( )
A.定期用清水冲洗,除去灰尘
B.放于体验区,让观众触摸
C.用盐水除去铁剑上的锈斑
D.放在充满氮气的展览柜中
焦亚硫酸钠在食品加工中常用作防腐剂、漂白剂和疏松剂。焦亚硫酸钠(Na2S2O6)中硫元素的化合价为( )
A.﹣2B.+3C.+4D.+5
下列有关水的说法正确的是( )
A.水中加入固体硝酸铵可降低溶液温度
B.通过活性炭的吸附可使硬水变为软水
C.为保护水资源,禁止使用化肥和农药
D.无色透明的深层地下水属于纯净物
如图是我国《可再生资源法》倡导的碳资源的转化与循环利用示意图。下列做法与该图体现的理念不符的是( )

A.将秸秆加工转化为酒精燃料
B.二氧化碳作为原料生产尿素
C.过度开采煤、石油作为燃料
D.将石油精炼,制备合成材料
下列实验方案不能达到实验目的是( )
选项 |
实验目的 |
实验方案 |
A |
区别聚乙烯与聚氯乙烯 |
分别将两种塑料灼烧,闻气味 |
B |
比较铜与银的金属活动性强弱 |
将铜和银分别放入盐酸中,观察现象 |
C |
区别天然气与一氧化碳 |
分别点燃两种气体,检验燃烧产物 |
D |
判断温度对溶解速率的影响 |
对比高锰酸钾固体在冷、热水中溶解的快慢 |
A.AB.BC.CD.D
下列四个图象中,能正确反映对应变化关系的是( )
|
|
|
|
A、用CuFe2O4﹣x做催化剂,光分解水制氢气与氧气 |
B、向氯化钠的饱和溶液中加入硝酸钾 |
C、向混有少量硫酸的硫酸铜溶液中加入氢氧化钠溶液 |
D、向一定质量的碳酸钠溶液中加水 |
A.AB.BC.CD.D
用符合要求的物质的序号填空.
①生石灰 ②盐酸 ③石墨 ④碘酒
(1)可用于伤口消毒的是 .
(2)可用于制作铅笔芯的是 .
(3)可用作食品干燥剂的是 .
质量守恒定律的发现对化学的发展作出了巨大贡献。
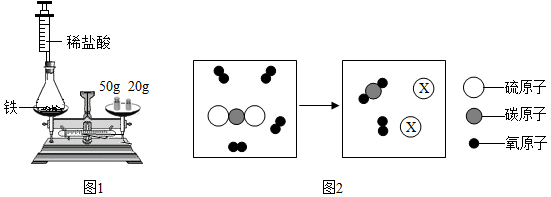
(1)为验证质量守恒定律,小华设计如图1所示装置进行实验。
实验时,先将装有药品的装置放在天平上,添加砝码,移动游码至天平平衡(如图1所示),然后取下装置,用针筒向锥形瓶中注入少量稀盐酸,反应后再将装置放置于天平上,观察到 ,从而验证了质量守恒定律。若将锥形瓶改为烧杯,则不能验证质量守恒定律,原因是 。
(2)某反应的微观示意图如图2所示。
①X的化学式是 。
②根据上述微观示意图,可得出化学反应遵循质量守恒定律的本质原因是 。
如图所示是四种物质的溶解度曲线图,请回答下列问题。
(1)在60℃时,四种物质中溶解度最大的是 。
(2)将40℃时氯化钾的不饱和溶液,保持溶液温度不变,制成饱和溶液,可行的方法有 (举1例)。
(3)在t℃时,将30g氯化铵加入50g水中,充分溶解,所得溶液质量分数为 (精确到0.1%)。
(4)向饱和食盐水中加入足量的碳酸氢铵固体,会有溶解度较小的碳酸氢钠晶体析出,该反应的化学方程式是NaCl+NH4HCO3=NaHCO3↓+NH4Cl,请根据以上信息和图中物质的溶解度曲线,简述以硫酸铵固体为原料制取较纯硫酸钾晶体的方法: 。

我国化学家傅鹰教授有一句名言“科学只给我们知识,而历史却给我们智慧”在化学学习中,了解知识的发展历程,可以促进我们正确理解科学本质。
(1)我国西汉时期就有“曾青得铁则化为铜”的记载,其中蕴涵的湿法冶铜原理为 (用化学方程式表示)。
(2)火药起源于唐朝。为使烟火产生耀眼的白光,可在其火药中加入 (填一种金属名称)。
(3)十八世纪,化学家们研究发现某些金属与酸反应能生成一种气体,该气体被喻为“会制造水的物质”,对上述反应原理的认识加快了推翻燃素学说的进程。该气体在空气中燃烧制造水的化学方程式是 。
(4)现代以来,人们对金属的认识不断深入,助推多种新材料的研制与使用。2017年5月5日我国首架试飞成功的大型客机C919使用了多种新材料,其中有锂铝合金,在飞机制造中使用该材料说明其具有的优点有 (填序号)。
①硬度大 ②密度小 ③易导电 ④耐腐蚀。
X、Y、Z、M、Q为生活中常见物质.Q为单质,其余为化合物,X为呼吸作用的产物,M为光合作用的产物,Z常温下为液体.各物质之间的转化关系如图所示(部分反应物、生成物、转化关系及反应条件未标出),回答下列问题:
(1)M属于 (填“无机物”或“有机物”).
(2)Q的化学式为 .
(3)若Y属于盐类物质,则X→Y可能发生的化学反应方程式是 (举1例).

根据如图回答下列问题:

(1)图B中标有序号①的仪器名称是 .
(2)组装好气体发生装置后,先应该检查装置的 ,然后再添加药品.
(3)欲收集密度比空气大的气体,应该选择的装置是 (填序号).
(4)实验室用石灰石与稀盐酸反应制取二氧化碳的化学方程式是 .
小文同学利用长柄W形玻璃管,完成了课本上多个化学实验.
(1)燃烧条件的探究与空气中氧气含量的粗略测定
①燃烧条件的探究:在如图1所示装置(省略夹持仪器,下同)中,向W形玻璃管中放入足量红磷和白磷,塞好橡皮塞,关闭活塞,然后将其放入80℃的热水中,观察到红磷不燃烧而白磷燃烧,说明可燃物发生燃烧应具备的条件是 .
②空气中氧气含量的粗略测定:为减小测量误差,待火焰熄灭后,将玻璃管 ,再打开活塞.
(2)一氧化碳与氧化铁反应
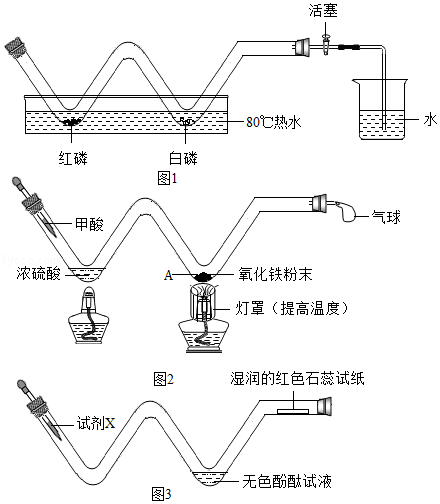
①甲酸(HCOOH)在热浓硫酸的作用下,分解生成一氧化碳和水,该反应的化学方程式是 .
②实验时,A处可以观察到的现象是 .
(3)探究微粒的性质
向玻璃管左端加入试剂X,观察到无色酚酞试液变红,湿润的红色石蕊试纸变蓝,试剂X可能是 ,该装置的优点有 (答1点).
氯化镁是一种重要的化工原料,同学们在实验室对其开展了系列研究.
课题1:选择制取氯化镁的原料
【查阅资料】
①全球海水中含有的盐类总质量为5亿吨,其中含有的各种离子占盐类总质量的百分含量如下表所示:
离子 |
Cl﹣ |
Na+ |
Mg2+ |
Ca2+ |
K+ |
其他 |
含量 |
55.06% |
30.61% |
3.69% |
1.15% |
1.10% |
… |
②工业生产中海水或卤水(海水晒盐后的剩余溶液)都可以作为制取氯化镁的原料.
【交流讨论】
同学们经讨论,一致选择卤水用于实验室制取氯化镁.你认为他们的理由是
.
课题2:由卤水制取氯化镁
同学们设计如图所示方案,从卤水中制取氯化镁.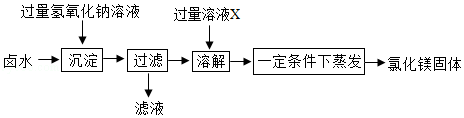
(1)溶液X的名称是 .
(2)部分同学认为上述制取方案不够完善,在“过滤”操作后缺少“洗涤”操作,从而导致制取的氯化镁不纯,可能混有的杂质是 .
课题3:测定氯化镁产品的纯度(氯化镁的质量分数)
同学们设计如下实验方案对制得的氯化镁进行纯度测定.
【实验步骤】
①称取9.5g氯化镁样品,放于烧杯中,加足量的水溶解,形成溶液;
②向上述溶液中加入90g质量分数为10%的氢氧化钠溶液;
③充分反应后,过滤;
④…
⑤向所得溶液中加入几滴无色酚酞试液,溶液变红,再逐滴加入10%稀硫酸(密度为1.07g•mL﹣1),并 ,当观察到溶液恰好褪色且30s内红色不复现,停止加入稀硫酸;
⑥计算氯化镁样品的纯度.
【问题讨论】
(1)为计算出氯化镁样品的纯度,除上述数据外,实验还需测量的数据是 .
(2)若缺少步骤④,则会导致氯化镁纯度测定不准确,步骤④的操作是 .
 B.
B.
 D.
D.




 粤公网安备 44130202000953号
粤公网安备 44130202000953号