2017年四川省宜宾市中考化学试卷
化学与生活息息相关,下列说法错误的是( )
A.人体缺铁会引起贫血
B.人体缺乏维生素C会引起坏血病
C.人体摄入过量油脂易引发肥胖
D.食用福尔马林浸泡的海鲜对人体无害
自来水厂的主要净水过程如下:取水→自然沉淀→过滤→活性炭吸附→消毒杀菌,其中主要涉及化学变化的过程是( )
A.自然沉淀B.过滤C.活性炭吸附D.消毒杀菌
下列有关燃烧和灭火的说法正确的是( )
A.燃烧必须有氧气参与
B.温度达到可燃物的着火点即可燃烧
C.煤气泄漏,应先打开排气扇换气
D.实验桌上少量酒精着火,立即用湿布盖灭
丙氨酸的分子式是C3H7O2N,下列有关丙氨酸的说法正确的是( )
A.属于有机物
B.含有1个NO2分子
C.碳元素与氢元素的质量比为3:7
D.相对分子质量为89g
下列关于物质分类正确的是( )
A.KClO3、Al2O3、P2O5都是氧化物
B.NH3•H2O、NaCl、KNO3都是盐
C.金刚石、液氧、汞都是单质
D.盐酸、生石灰、生铁都是纯净物
氯酸钠受到撞击发生如下反应:2NaClO3═2NaCl+3O2↑.下列有关说法错误的是( )
A.该反应为分解反应
B.NaClO3中氯元素的化合价为+3价
C.反应前后氧原子的个数不变
D.运输氯酸钠时应轻拿轻放
下列实验操作能达到实验目的是( )
选项 |
实验目的 |
实验操作 |
A |
验证金属活动性:Fe>Cu |
将铁丝伸入硫酸铜溶液 |
B |
除去NaNO3溶液中的Na2CO3 |
向溶液中滴入适量CaCl2溶液、过滤 |
C |
证明稀硫酸与氢氧化钠溶液恰好完全反应 |
向反应后的溶液中滴加氯化钡溶液 |
D |
证明溶液中一定含Cl﹣ |
向溶液中滴入AgNO3溶液 |
A.AB.BC.CD.D
A、B、C三种物质的溶解度曲线如图,下列说法正确的是( )

A.温度高于T2℃时,A、B、C的溶解度:A>B>C
B.温度由T1℃升至T2℃,含C的溶液溶质质量分数一定减小
C.除去A中混有的少量B,可采用冷却热饱和溶液方法实现
D.A、B、C的不饱和溶液不能通过相同的方法形成饱和溶液
用化学用语填空:
(1)2个铝离子 ;(2)小苏打 ;
(3)5个硝酸根 ;(4)五氧化二磷 ;
(5)点燃条件下,某反应的微观过程如图:
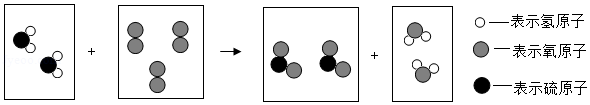
写出该图中所示反应的化学方程式 。
如图为元素周期表的一部分,回答下列问题.
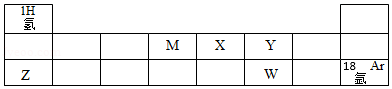
(1)Y的原子结构示意图 ,在化学反应中该原子容易 (填“得到”或“失去”)电子.
(2)Z的原子序数是 ,W2﹣离子的核外电子总数是 .
(3)M、X、Y、Z、W中某两种元素组成的物质能用于人工降雨,该物质是 (填化学式),构成该物质的微粒是 (填“分子”“原子”或“离子”).
(4)汽车安全气囊中装有ZX3,受到撞击时,传感器发出加热指令,引发ZX3,迅速分解生成两种单质,放出的气体能在30毫秒内充满气囊,该反应的化学方程式为 .
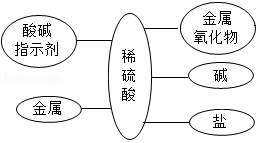
通过构建知识网络,可以帮助我们理解知识间的内在联系,如图是稀硫酸与不同类别物质之间反应的知识网络图。
(1)稀硫酸与锌反应的反应类型是 。
(2)可用稀硫酸与 、 等不同类的物质反应制取硫酸铜。
(3)向氯化钡溶液中加入一定量的硫酸溶液,反应后过滤,滤液中一定含有的溶质是 ____(填化学式,下同),可能存在的溶质是 。
如图,要使石头滚下,山羊必须给石头一个足够“翻越小坡”的能量(E),当石头滚落到谷底时会释放能量,化学反应就如那块石头一样,反应物需要一定的能量才能“翻越小坡”,反应才会发生。若反应中加入催化剂,可降低“翻越小坡”需要的能量,任何化学反应都伴随着能量变化,若反应物的总能量比生成物的总能量高,该反应为放热反应,反之,则为吸热反应,反应中放出或吸收的能量等于反应物总能量与生成物总能量的差值。

(1)图1表示 (填“放热”或“吸热”)反应,反应物总能量与生成物总能量的差值是 (用代数式表示,下同),反应所需“翻越小坡”的能量是 。
(2)图2中曲线a、b表示同一反应在不同条件下的反应过程,曲线 (填“a”或“b”)表示一定加入了催化剂的反应过程。
(3)氢气在氧气中燃烧生成水,水分解为氢气和氧气的反应是 (填“放热”或“吸热”)
根据下列实验装置或操作示意图回答问题:
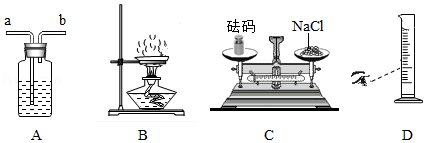
(1)用图A装置干燥O2,广口瓶内盛放的试剂是 ,气体应从 (填“a”或“b”)口进入.
(2)图B是蒸发食盐水操作,缺少的仪器是 ,组装该装置时,放置仪器的先后顺序是 (填数字序号).
①铁架台 ②铁圈 ③蒸发皿 ④酒精灯
(3)配制一定溶质质量分数的氯化钠溶液,图C中称量操作的错误之处是 .若其他操作均正确,按图D所示量取蒸馏水,则配制的氯化钠溶液浓度会 (填“偏大”“偏小”或“无影响”).
某同学向FeSO 4溶液中滴加NaOH溶液时,发现生成的白色沉淀表面总是慢慢出现红褐色。为获得稳定的白色沉淀,该同学进行了以下实验。

【查阅资料】
Ⅰ.Fe(OH) 2为难溶于水的白色固体,Fe(OH) 3为难溶于水的红褐色固体;
Ⅱ.Fe 2+易与氧气反应生成Fe 3+;
Ⅲ.Fe 2(SO 4) 3+Fe═3FeSO 4;
Ⅳ.FeSO 4溶液遇KSCN溶液不显红色,Fe 2(SO 4) 3溶液遇KSCN溶液显红色;
Ⅴ.植物油不溶于水且密度比水小。
(1)FeSO 4溶液与NaOH溶液反应的化学方程式是 。
【提出问题】在无氧气的环境中,Fe(OH) 2能否稳定存在?
【进行实验】
Ⅰ.配制FeSO 4溶液
(2)取少量FeSO 4固体溶于水,加入少量铁粉,振荡,加入铁粉的目的是 ;取少量新配制的FeSO 4溶液于试管中,滴加几滴KSCN溶液,未变红色,说明溶液中不含 (填化学式)。
Ⅱ.制取Fe(OH) 2
(3)如图①:挤压胶头让NaOH溶液与FeSO 4溶液接触,产生白色沉淀,并能较长时间保持白色,硫酸亚铁溶液上方植物油的作用是 。
(4)如图②:组装好仪器,检查气密性,加入试剂,打开止水夹,待a口收集的氢气纯净后,关闭止水夹,此时观察到图②中出现的现象是 。白色沉淀能较长时间保持,该实验中氢气的作用是 。
【实验结论】
无氧气的环境中,Fe(OH) 2能稳定存在。
(5)有氧气存在时,Fe(OH) 2易与氧气反应生成Fe(OH) 3.请完成下列化学方程式:
4Fe(OH) 2+O 2+ ═4Fe(OH) 3。
 B.
B.
 D.
D.
 粤公网安备 44130202000953号
粤公网安备 44130202000953号