2015年全国统一高考化学试卷(江苏卷)
"保护环境"是我国的基本国策。下列做法不应该提倡的是( )
| A. | 采取低碳、节俭的生活方式 | B. | 按照规定对生活废弃物进行分类放置 |
| C. | 深入农村和社区宣传环保知识 | D. | 经常使用一次性筷子、纸杯、塑料袋等 |
下列有关氯元素及其化合物的表示正确的是



下列说法正确的是()
| A. | 分子式为 的有机化合物性质相同 |
| B. |
相同条件下,等质量的碳按a、b两种途径完全转化,途径a比途径b放出更多热能
途径a: 途径b: |
| C. | 在氧化还原反应中,还原剂失去电子总数等于氧化剂得到电子的总数 |
| D. | 通过化学变化可以直接将水转变为汽油 |
在中,燃烧生成和。下列说法正确的是
元素C的单质只存在金刚石和石墨两种同素异形体
、中镁元素微粒的半径:
在该反应条件下,的还原性强于的还原性
该反应中化学能全部转化为热能
短周期主族元素、、、原子序数依次增大,原子最外层有6个电子,是至今发现的非金属性最强的元素,在周期表中处于周期序数等于族序数的位置,的单质广泛用作半导体材料。下列叙述正确的是( )
常温下,下列各组离子一定能在指定溶液中大量共存的是( )
| A. | 使酚酞变红色的溶液中: 、 、 、 |
| B. | =1×10 -13 · 的溶液中: 、 、 、 |
| C. | 与 反应能放出 的溶液中: 、 、 、 |
| D. | 水电离的 ( )=1×10 -13 的溶液中: 、 、 、 |
下列实验操作正确的是

给定条件下,下列选项中所示的物质间转化均能一步实现的是()
| A. | 粗硅 |
| B. | |
| C. | 无水 |
| D. |
下列指定反应的离子方程式正确的是()
| A. | 氯气溶于水: |
| B. | 溶液中 的水解: |
| C. | 酸性溶液中 与 反应生成 : |
| D. | 溶液中加足量 溶液: |
一种熔融碳酸盐燃料电池原理示意如图。下列有关该电池的说法正确的是( )
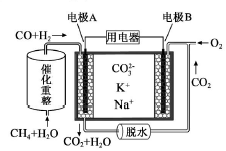
 ,每消耗1
转移12
电子
,每消耗1
转移12
电子
下列说法正确的是
 达到平衡时,
正(
)=
逆(
)
达到平衡时,
正(
)=
逆(
)
己烷雌酚的一种合成路线如下:
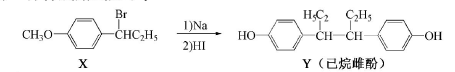
下列叙述正确的是
下列设计的实验方案能达到实验目的的是
室温下,向下列溶液中通入相应的气体至溶液=7(通入气体对溶液体积的影响可忽略),溶液中部分微粒的物质的量浓度关系正确的是( )
在体积均为1.0的量恒容密闭容器中加入足量的相同的碳粉,再分别加入0.1和0.2,在不同温度下反应 达到平衡,平衡时的物质的量浓度随温度的变化如图所示(图中Ⅰ、Ⅱ、Ⅲ点均处于曲线上)。下列说法正确的是( )
达到平衡,平衡时的物质的量浓度随温度的变化如图所示(图中Ⅰ、Ⅱ、Ⅲ点均处于曲线上)。下列说法正确的是( )
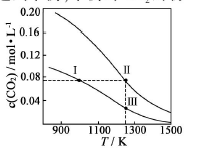
| A. |
反应

|
| B. | 体系的总压强 总: 总(状态Ⅱ)>2 总(状态Ⅰ) |
| C. | 体系中 ( ): ( ,状态Ⅱ)<2 ( ,状态Ⅲ) |
| D. | 逆反应速率V逆:V逆(状态Ⅰ)>V逆(状态Ⅲ) |
以磷石膏(只要成分
,杂质
、
等)为原料可制备轻质
。

(1)匀速向浆料中通入
,浆料清液的
和
随时间变化见由下图。清液
时
转化的离子方程式;能提高其转化速率的措施有(填序号)
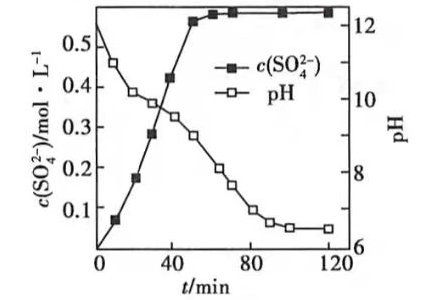
| A. | 搅拌浆料 | B. | 加热浆料至100℃ |
| C. | 增大氨水浓度 | D. | 减小 通入速率 |
(2)当清液pH接近6.5时,过滤并洗涤固体。滤液中物质的量浓度最大的两种阴离子为和(填化学式);检验洗涤是否完全的方法是。
(3)在敞口容器中,用
溶液浸取高温煅烧的固体,随着浸取液温度上升,溶液中
增大的原因。
化合物是一种抗心肌缺血药物的中间体,可以通过以下方法合成:

(1)化合物中的含氧官能团为
(2)化合物的结构简式为
(3)写出同时满足下列条件的E的一种同分异构体的结构简式
Ⅰ.分子含有2个苯环 Ⅱ.分子中含有3种不同化学环境的氢
(4)已知: ,请写出以
,请写出以 为原料制备化合物X(结构简式见图
为原料制备化合物X(结构简式见图 )的合成路线流程图(无机试剂可任选)。合成路线流程图示例如下:
)的合成路线流程图(无机试剂可任选)。合成路线流程图示例如下:
软锰矿(主要成分,杂质金属元素、、等)的水悬浊液与烟气中反应可制备,反应的化学方程式为:
(1)质量为17.40纯净最多能氧化(标准状况)。
(2)已知:=1×10-33,=3×10-39,=7.1时开始沉淀。室温下,除去溶液中的、(使其浓度小于1×10-6),需调节溶液范围为。
(3)右图可以看出,从和混合溶液中结晶晶体,需控制结晶温度范围为。

(4)准确称取0.1710样品置于锥形瓶中,加入适量和溶液,加热使全部氧化成,用=0.0500的标准溶液滴定至终点(滴定过程中被还原为),消耗溶液20.00。计算样品的纯度(请给出计算过程)
实验室用下图所示装置制备溶液,并通过溶液与溶液的反应制备高效水处理剂。已知具有下列性质①可溶于水、微溶于浓溶液,②在0℃--5℃、强碱性溶液中比较稳定,③在和催化作用下发生分解,④在酸性至弱碱性条件下,能与水反应生成和。

(1)装置A中与盐酸反应生成和,其离子方程式为
(2)和KOH在较高温度下反应生成。在不改变KOH溶液的浓度和体积的条件下,控制反应在0℃~5℃进行,实验中可采取的措施是
(3)制备时,饱和溶液与饱和溶液的混合方式为
(4)提纯粗产品[含有、等杂质]的实验方案为:将一定量的粗产品溶于冷的3mol·L-1溶液中,
烟气(主要污染物、)经预处理后用水悬浮液吸收,可减少烟气中、的含量。氧化烟气中、的主要反应的热化学方程式为:
(1)反应的=
(2)室温下,固定进入反应器的、的物质的量,改变加入的物质的量,反应一段时间后体系中、和随反应前的变化见右图。

①当>1时,反应后的物质的量减少,其原因是
②增加,氧化的反应几乎不受影响,其可能原因是
(3)当用水悬浮液吸收经预处理的烟气时,清液(约为 8)中将转化为,其离子方程式为:
(4)水悬浮液中加入溶液,达到平衡后溶液中=
下列反应曾用于检测司机是否酒后驾驶:
(1)基态核外电子排布式为
(2)中原子轨道杂化类型为
(3)与互为等电子体的一种阳离子为
实验室以苯甲醛为原料制备间溴苯甲醛(实验装置见下图,相关物质的沸点见附表)。其实验步骤为:
步骤1:将三颈瓶中的一定配比的无水
、1,2-二氯乙烷和苯甲醛充分混合后,升温至60℃,缓慢滴加经浓硫酸干燥过的液溴,保温反应一段时间,冷却。
步骤2:将反应混合物缓慢加入一定量的稀盐酸中,搅拌、静置、分液。有机相用10%
溶液洗涤。
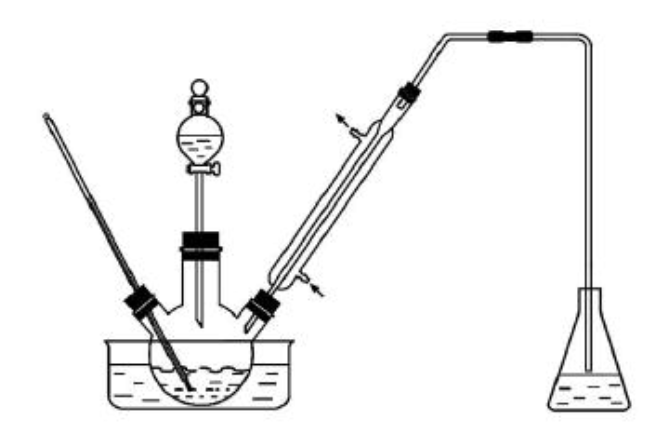
步骤3:经洗涤的有机相加入适量无水
固体,放置一段时间后过滤。
步骤4:减压蒸馏有机相,收集相应馏分。
(1)实验装置中冷凝管的主要作用是,锥形瓶中的溶液应为。
(2)步骤1所加入的物质中,有一种物质是催化剂,其化学式为。
(3)步骤2中用10%
溶液洗涤有机相,是为了除去溶于有机相的(填化学式)。
(4)步骤3中加入无水
固体的作用是。
(5)步骤4中采用减压蒸馏技术,是为了防止
附表 相关物质的沸点(101kPa)
| 物质 |
沸点/℃ |
物质 |
沸点/℃ |
| 溴 |
58.8 |
1,2-二氯乙烷 |
83.5 |
| 苯甲醛 |
179 |
间溴苯甲醛 |
229 |
 粤公网安备 44130202000953号
粤公网安备 44130202000953号