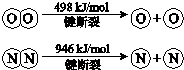
软锰矿(主要成分,杂质金属元素、、等)的水悬浊液与烟气中反应可制备,反应的化学方程式为:
(1)质量为17.40纯净最多能氧化(标准状况)。
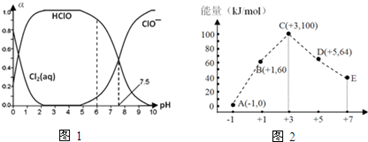
(2)已知:=1×10-33,=3×10-39,=7.1时开始沉淀。室温下,除去溶液中的、(使其浓度小于1×10-6),需调节溶液范围为。
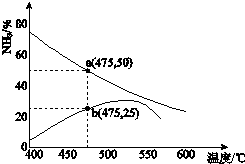
(3)右图可以看出,从和混合溶液中结晶晶体,需控制结晶温度范围为。

(4)准确称取0.1710样品置于锥形瓶中,加入适量和溶液,加热使全部氧化成,用=0.0500的标准溶液滴定至终点(滴定过程中被还原为),消耗溶液20.00。计算样品的纯度(请给出计算过程)
 B+D在四种不同条件下进行,B、D起始浓度为0。反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表:
B+D在四种不同条件下进行,B、D起始浓度为0。反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表: N2O4(g),△H<0,试根据下列图象判断t2、t3、t4时刻采取的措(只改变一种外部条件)。
N2O4(g),△H<0,试根据下列图象判断t2、t3、t4时刻采取的措(只改变一种外部条件)。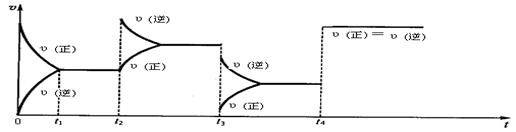
 2C(g) ΔH < 0。此反应的平衡常数表达式K=__________,温度降低,
2C(g) ΔH < 0。此反应的平衡常数表达式K=__________,温度降低, 粤公网安备 44130202000953号
粤公网安备 44130202000953号