高考原创化学预测卷 07(新课标I卷)
【原创】化学无处不在,下列与化学有关的说法,正确的是
| A.食用白糖的主要成分是蔗糖,小苏打的主要成分是碳酸钠 |
| B.在食品袋中放入盛有硅胶和铁粉的透气小袋,可防止食物受潮、氧化变质 |
| C.食盐、食醋和味精是常用的食品添加剂,其主要成分均属钠盐 |
| D.蛋白质是人类必需的营养物质,也是产生能量最高的营养物质 |
【原创】水杨酸在临床试验上可用来降低糖尿病患者长期并发心脏病的风险,结构简式为
其中能发生银镜反应且遇氯化铁溶液显紫色的有机物同分异构体有
| A.3种 | B.6种 | C.9种 | D.10种 |
【原创】设NA为阿伏加德罗常数的值。下列叙述正确的是
| A.常温下,0.1mol/LNa2CO3溶液中,含有阴离子的总数大于0.1NA |
| B.标准状况下,20g SO3所含分子的数目是0.25NA |
| C.1mol氯气与Fe反应,一定转移3NA个电子 |
| D.16gCH4与18gNH4+ 所含质子数相等 |
【原创】如图装置可用于收集气体并验证其某些化学性质,你认为正确的是
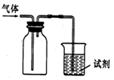
| 选项 |
气体 |
试剂 |
现象 |
结论 |
| A |
C12 |
紫色石蕊试液 |
溶液先变红后褪色 |
Cl2有酸性和漂白性 |
| B |
NH3 |
氯化铝溶液 |
溶液变浑浊 |
氨水不能溶解氢氧化铝 |
| C |
SO2 |
溴水 |
溶液褪色 |
SO2有还原性 |
| D |
H2S |
硫酸铜溶液 |
有黑色沉淀产生 |
氢硫酸的酸性强于硫酸 |
【原创】一定温度下,下列溶液的离子浓度关系式正确的是
A.0.l mol·L-1的NaHS溶液中:c(OH-)=c(H+)+c(H2S)
B.往氯化铵溶液中加水,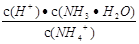 的值变大
的值变大
C.0.1 mol/L的NaOH溶液与0.2 mol/L的HA溶液等体积混合,所得溶液呈碱性:c (Na+)>c (HA)>c (A-)>c (OH-)>c (H+)
D.pH相等的①NH4Cl ②NH4Al(SO4)2③NH4HSO4溶液中:c(NH4+)大小顺序:①>②>③
某温度时,卤化银(AgX,X=Cl,Br,I)的3条溶解平衡曲线如图所示,AgCl,AgBr,AgI的Ksp依次减小。已知pAg=-lgc(Ag+),pX=-lgc(X-),利用pX—pAg的坐标系可表示出AgX的溶度积与溶液中的c(Ag+)和c(X-)的相互关系。下列说法错误的是
| A.e点表示由过量的KI与AgNO3反应产生AgI沉淀 |
| B.A线是AgCl的溶解平衡曲线,C线是AgI的溶解平衡曲线 |
| C.d点是在水中加入足量的AgBr形成的饱和溶液 |
| D.坐标点(8,4)形成的溶液是AgCl的不饱和溶液 |
某溶液中含有如下离子组中的若干种:K+、Mg2+、Fe3+、Fe2+、CO32-、NO3-、SO42-、I-、SiO32-、Cl-且物质的量浓度相同。某同学欲探究该溶液的组成,进行了如下实验:
Ⅰ.用铂丝蘸取少量溶液,在火焰上灼烧,透过蓝色钴玻璃,观察到浅紫色火焰;
Ⅱ.另取原溶液加入足量盐酸有无色气体生成,该气体遇空气变成红棕色,此时溶液颜色加深,但无沉淀生成;
Ⅲ.取Ⅱ反应后的溶液分置于两支试管中加入BaCl2溶液,有白色沉淀生成,再滴加KSCN溶液上层清液变红;第二支试管中加入CCl4,充分振荡静置后溶液分层,下层出现紫红色。下列说法正确的是
| A.原溶液中肯定不含Mg2+、SiO32- |
| B.步骤Ⅱ中无色气体可能含有CO2,原溶液中可能含有CO32- |
| C.原溶液由K+、Fe2+、NO3-、I-、SO42-五种离子组成 |
| D.原溶液中一定含有Mg2+、Cl- |
实验室常用苯甲醛在浓氢氧化钠溶液中制备苯甲醇和苯甲酸,反应如下:

已知:
①苯甲酸在水中的溶解度为:0.18g(4℃)、0.34g(25℃)、0.95g(60℃)、6.8g(95℃)。
②乙醚沸点34.6℃,密度0.7138,易燃烧,当空气中含量为1.83~48.0%时易发生爆炸。
③石蜡油沸点高于250℃;④苯甲醇沸点为205.3℃。

实验步骤如下:
①向图l所示装置中加入8g氢氧化钠和30mL水,搅拌溶解。稍冷,加入10 mL苯甲醛。开启搅拌器,调整转速,使搅拌平稳进行。加热回流约40 min。
②停止加热,从球形冷凝管上口缓缓加入冷水20 mL,摇动均匀,冷却至室温。然后用乙醚萃取三次,每次10 mL。水层保留待用。合并三次萃取液,依次用5 mL饱和亚硫酸氢钠溶液洗涤,10 mL 10%碳酸钠溶液洗涤,10 mL水洗涤,然后分液,将水层弃去,所得醚层进行实验步骤③。
③将分出的醚层,倒入干燥的锥形瓶中,加无水硫酸镁,注意锥形瓶上要加塞。将锥形瓶中溶液转入图2 所示的蒸馏装置,先缓缓加热,蒸出乙醚;蒸出乙醚后必须改变加热方式、冷凝方式,继续升高温度并收集205℃~206℃的馏分得产品A。
④将实验步骤②中保留待用的水层慢慢地加入到盛有30 mL浓盐酸和30 mL水的混合物中,同时用玻璃棒搅拌,析出白色固体。冷却,抽滤,得到粗产品,然后提纯得产品B。
根据以上步骤回答下列问题:
(1)步骤②萃取时用到的玻璃仪器除了烧杯、玻璃棒外,还需 (仪器名称)。
(2)步骤②中饱和亚硫酸氢钠溶液洗涤是为了除去 ,而用碳酸钠溶液洗涤是为了除去醚层中极少量的苯甲酸。醚层中少量的苯甲酸是从水层转移过来的,请用离子方程式说明其产生的原因 。
(3)步骤③中无水硫酸镁的作用是 ,锥形瓶上要加塞的原因是 ,产品A为 。
(4)步骤③中蒸馏除去乙醚的过程中采用的加热方式为 ;蒸馏得产品A的加热方式是 。
(5)步骤④中提纯产品B时所用到的实验方法为_______。
【改编】钛被称为“二十一世纪金属”,工业上用钛铁矿制备金属钛的工艺流程如下:

已知:TiOSO4遇水会水解。
请回答下列问题:
(1)过滤操作的主要玻璃仪器有烧杯 。
(2)操作I的实验步骤为:_________________,过滤。副产品主要成分的化学式为 。
(3)加入过量铁粉的作用是:① ;② 。
(4)请结合化学用语用化学平衡理论解释将TiO2+转化为H2TiO3的原理________________。
(5)已知钛的还原性介于铝与锌之间,估计钛能耐腐蚀的原因之一是___________。如果可从Na、Zn、Fe三种金属中选一种金属代替流程中的镁,那么该金属跟四氯化钛反应的化学方程式是_______。
(6)电解TiO2来获得Ti是以TiO2作阴极,石墨为阳极,熔融CaO为电解液,用碳块作电解槽池,其阴极反应的电极反应式是________________。
【原创】CO、CO2、H2、H2O、CH4等物质是常见的基础化学物质,这些物质与人类的生产、生活有密切关系。科研人员深入研究这些物质,应用它们合成CH3OH、CH3CH2OH、CH3OCH3等已经实现。
(1)实现反应CH4(g)+CO2(g) 2CO(g)+2H2(g) △H,对减少温室气体排放和减缓燃料危机具有重要意义。
2CO(g)+2H2(g) △H,对减少温室气体排放和减缓燃料危机具有重要意义。
已知:2CO(g)+O2(g)=2CO2(g) △H=—566kJ/mol
2H2(g)+O2(g)=2H2O(g) △H=—484kJ/mol
CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H=—802kJ/mol
则反应CH4(g)+CO2(g) 2CO(g)+2H2(g)的△H=________;
2CO(g)+2H2(g)的△H=________;
(2)CO2和H2充入一定体积的密闭容器中,在两种不同温度下发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g)测得CH3OH的物质的量随时间的变化如图所示。
CH3OH(g)+H2O(g)测得CH3OH的物质的量随时间的变化如图所示。

①曲线I、Ⅱ对应的平衡常数大小关系为KI_____KⅡ(填“>”或“=”或“<”);
②一定温度下,此反应在恒压容器中进行,能判断该反应达到化学平衡状态依据的是_____。
a.容器中压强不变 b.H2的体积分数不变
c.c(H2)=3c(CH3OH) d.2个C=O断裂的同时有6个H—H断裂
③若在一定温度时,将lmol CO2和2mol H2充入一密闭恒容容器中,充分反应5min后达到平衡,CO2的转化率为60%,则用氢气表示的反应速率为_________,该温度下的平衡常数为_________;若容器容积不变,下列措施可增加甲醇产率的是____________。
a.升高温度
b.增加CO2的量
c.充入He,使体系总压强增大
d.按原比例再充入CO2和H2
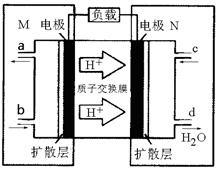
(3)某甲醇燃料电池原理如图所示:,则N电极是______极(填“正”或“负”),M区发生反应的电极反应式为_______________________________。
【化学选修——2:化学与技术】水处理技术在生产、生活中应用广泛。
(1)根据水中Ca2+、Mg2+的多少,把天然水分为硬水和软水,硬水必须经过软化才能使用。
①硬水软化的方法通常有___________、__________和离子交换法。离子交换树脂使用了一段时间后,逐渐由NaR型变为CaR2(或MgR2)型,而失去交换能力。把CaR2(或MgR2)型树脂置于____中浸泡一段时间,便可再生。
②当洗涤用水硬度较大时,洗衣粉与肥皂相比,_______洗涤效果较好,原因是_______________。
(2)工业上常用绿矾做混凝剂除去天然水中含有的悬浮物和胶体,为了达到更好的效果,要将待处理的水pH调到9左右,再加入绿矾。请解释这一做法的原因:__________。(用必要的离子方程式和文字描述)。
(3)最近我国某地苯胺大量泄漏于生活饮用水的河道中,当地采取的应急措施之一是向河水中撒入大量的活性炭,活性炭的作用是___________________。
【化学——选修3:物质结构与性质】决定物质性质的重要因素是物质结构。请回答下列问题:
(1)已知A和B为第三周期元素,其原子的第一至第四电离能如下表所示:
| 电离能/kJ·mol-1 |
I1 |
I2 |
I3 |
I4 |
| A |
578 |
1817 |
2745 |
11578 |
| B |
738 |
1451 |
7733 |
10540 |
A通常显____价,A的电负性______B的电负性(填“>”、“<”或“=”)。
(2)紫外光的光子所具有的能量约为399 kJ·mol-1。根据下表有关蛋白质分子中重要化学键的信息,说明人体长时间照射紫外光后皮肤易受伤害的原因___________;组成蛋白质的最简单的氨基酸中的碳原子杂化类型是 ;
| 共价键 |
C-C |
C-N |
C-S |
| 键能/ kJ·mol-1 |
347 |
305 |
259 |
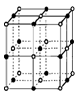
(3)实验证明:KCl、MgO、CaO、TiN这4种晶体的结构与NaCl晶体结构相似(如图所示),已知3种离子晶体的晶格能数据如下表:
| 离子晶体 |
NaCl |
KCl |
CaO |
| 晶格能/kJ·mol-1 |
786 |
715 |
3401 |
则该4种离子晶体(不包括NaCl)熔点从高到低的顺序是:_______________;其中MgO晶体中一个Mg2+周围和它最邻近且等距离的Mg2+有 个。
(4)[LiC60]PF6与NaCl具有类似的晶胞结构([LiC60]+表示1个Li+位于1个C60内部)。[LiC60]PF6晶体中包含的化学键有_____________(填字母);
A.金属键
B.离子键
C.极性键
D.非极性键
E.范德华力
已知[LiC60]PF6晶体晶胞边长为a nm,计算[LiC60]PF6晶体的密度为_______g/cm3(用含a、NA的式子表示)。
【改编】【化学——选修5:有机化学基础】5-氯-2,3-二氢-1-茚酮是是一种重要的医药中间体。
已知:
以化合物A(分子式为C7H7Cl)为原料合成5-氯-2,3-二氢-1-茚酮(化合物F)工艺流程如下:
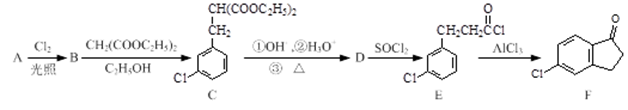
(1)A的名称为 ,C分子中含氧官能团的名称为_______,反应D→E的反应类型 。
(2)1molB在一定条件下最多能与______molNaOH反应。
(3)E→F的化学方程为 。
(4)写出满足下列条件的有机物D的同分异构体的结构简式: (任写一种)。
①1,3,5—三取代苯,但不含甲基;
②能发生银镜反应;
③与氯化铁溶液显紫色
(5)根据已有知识并结合相关信息,写出以化合物F和CH2(COOC2H5)2为有机反应原料制备 的合成路线流程图(注明反应条件)。合成路线流程图示例如下:
的合成路线流程图(注明反应条件)。合成路线流程图示例如下:

 粤公网安备 44130202000953号
粤公网安备 44130202000953号