农谚“雷雨发庄稼”的化学原理是:雷电时雨水里含有微量硝酸。硝酸的形成过程如图:
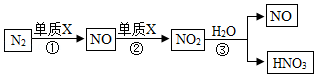
回答下列问题:
(1)单质X是一种常见气体,其化学式是 。
(2)反应②属于基本反应类型中的 反应。
(3)反应③在常温下即可发生,该反应的化学方程式是 。
(4)为了提高氮原子的利用率,可循环利用的物质是 (填化学式)。
(5)在实验室通常采用以下方法制取NO:4□+5O2 4NO+6H2O,“□”中物质的化学式为 ,因为在化学反应前后原子的 没有改变。
农谚“雷雨发庄稼”的化学原理是:雷电时雨水里含有微量硝酸。硝酸的形成过程如图:

回答下列问题:
(1)单质X是一种常见气体,其化学式是 。
(2)反应②属于基本反应类型中的 反应。
(3)反应③在常温下即可发生,该反应的化学方程式是 。
(4)为了提高氮原子的利用率,可循环利用的物质是 (填化学式)。
(5)在实验室通常采用以下方法制取NO:4□+5O2 4NO+6H2O,“□”中物质的化学式为 ,因为在化学反应前后原子的 没有改变。